알코올성 간경변증 진단에 유용한 초음파점수체계
Usefulness of Ultrasonographic Scoring System in Diagnosis of Alcoholic Cirrhosis
Article information
Abstract
목적
간 조직검사로 확인된 알코올성 간경변증 진단에 간탄력도검사와 비교하여 변형된 초음파점수체계의 임상적 유용성을 알아보고자 하였다.
방법
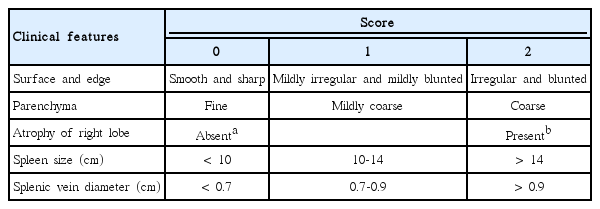
105명의 알코올성 간질환 환자를 대상(남성 96명, 여성 6명; 평균 나이 50.5 ± 10.0)으로 전향적으로 연구를 시행하였다. 1차 의료 임상 의사가 손쉽게 사용할 수 있도록 Moon 등[9]의 초음파점수체계에서 도플러 이미지를 제외한 변형된 초음파점수체계 (간표면 요철 정도, 간실질 에코 변화, 간우엽위축 정도, 비장종대 여부, 비장정맥의 굵기)를 설정하였다. 간경변증 진단시 간탄력도검사와 비교하여 변형된 초음파점수체계의 유용성을 비교 분석하였다.
결과
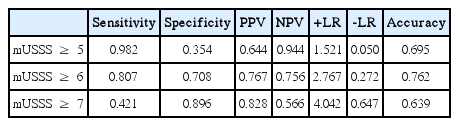
간경변증(F4, F4a-F4c) 진단 시에 변형된 초음파점수체계의 AUROC는 0.822로 간탄력도검사의 AUROC인 0.733보다 높게 분석되었다. 분석된 ROC 곡선을 토대로 변형된 초음파점수체계의 절단값은 5점 이상이었으며, 민감도, 특이도, 양성예측도, 음성예측도, 양성우도비율, 음성우도비율, 정확도는 각각 0.957, 0.429, 0.770, 0.833, 1.675, 0.100, 0.781로 분석되었다. 중등도-중도 간경변증(F4b-F4c) 진단 시에 변형된 초음파점수체계의 AUROC는 0.803로 간탄력도검사의 AUROC인 0.754보다 높게 분석되었다. 분석된 ROC 곡선을 토대로 변형된 초음파점수체계의 절단값은 6점 이상이었으며, 민감도, 특이도, 양성예측도, 음성예측도, 양성우도비율, 음성우도비율, 정확도는 각각 0.807, 0.708, 0.767, 0.756, 2.767, 0.272, 0.762로 분석되었다.
결론
변형된 초음파점수체계는 간탄력도검사와 더불어 알코올성 간경변증을 조기에 진단하는데 유용함을 알 수 있다.
Trans Abstract
Background/Aims
To evaluate the usefulness of modified ultrasonographic scoring system (mUSSS) compared to that of liver stiffness measurement (LSM) by transient elastography in diagnosis of mild to moderate cirrhosis.
Methods
One hundred and five patients with only alcoholic liver disease (96 males, 9 females; age, 50.5 ± 10.0 year-old) were enrolled in this prospective study. Considering the convenient use of primary medical doctors, we modified the ultrasonographic scoring system reported previously. The mUSSS is composed of 5 parameters; nodularity of the liver surface and edge, parenchyma echogenicity, presence of right-lobe atrophy, spleen size, and splenic vein diameter. The accuracy of mUSSS and LSM in diagnosis of cirrhosis (Laennec fibrosis stage: F4a-F4c) were conducted.
Results
The area under the receiver operating characteristic (ROC) curves of mUSSS and LSM in diagnosis of mild to severe cirrhosis (F4a-F4c) were 0.822 (95% confidence interval [CI] 0.736-0.907) and 0.733 (95% CI 0.625-0.840), respectively. In case of moderate to severe cirrhosis (F4b-F4c), 0.803 for mUSSS (95% CI 0.717-0.890) and 0.754 for LSM (95% CI 0.656-0.853). On basis of ROC curves, more than 5 of mUSSS had 0.957 for sensitivity, 0.429 for specificity, 0.781 for accuracy, in diagnosis of mild to severe cirrhosis. In case of moderate to severe cirrhosis, more than 6 of mUSSS had 0.807 for sensitivity, 0.708 for specificity, 0.762 for accuracy.
Conclusions
In diagnosing alcoholic cirrhosis, mUSSS may have more comparable efficacy than LSM.
서 론
간경변증은 간조직의 미만성 섬유화와 실질의 위축, 불규칙한 재생결절의 형성, 간조직 괴사와 재생 등의 병리조직학적 소견을 특징으로 하는 질환이다[1]. 복수, 식도정맥류 출혈, 간성뇌증 등의 간경변증 합병증이 나타나면, 5년 생존율이 21-40%로 예후가 매우 불량하기 때문에[2], 임상의에게는 합병증을 동반한 비대상 간경변증 환자들로 진행할 가능성이 높은 조기 간경변증 환자를 선별하여 세심하게 관리를 하는 것이 중요하다. 간섬유화는 만성 간질환, 특히 간경변증의 중요한 예후인자로서, 간섬유화의 정도를 평가하는 것이 치료를 결정하고 추적관찰하는 데 있어 필수적이다.
간섬유화 정도를 평가하고 간경변증을 확진하기 위해서는 간조직검사를 시행한 후 병리학적 진단이 이루어져야 한다[3,4]. 간 조직검사는 비교적 안전한 침습적인 진단방법임에도 불구하고, 3% 정도의 합병증과 0.03%의 사망률의 위험성이 있다[5]. 또한 부적절한 검체를 얻게 되는 경우에는 위음성 결과로 나와 표본추출 오류가 발생할 수 있으며, 작은 조직만으로 진단해야 하기 때문에 병리 의사 간에도 판독에 오차가 발생할 수 있어서 실제로 임상에서, 대학병원과 같은 큰 병원을 제외하고는 간경변증의 진단을 위해 널리 시행되지 않는다.
초음파펄스진단장치인 간섬유화스캔(transient elastography)은 비침습적이고 신속하게 간탄력도(liver stiffness measurement, LSM)를 측정하여 간섬유화를 평가하는 새로운 진단방법으로[6], 최근 여러 문헌에서 간탄력도와 간조직에 의한 간섬유화의 정도가 유의한 상관관계를 보였다[6-15]. 아직 제한 사항들이 있긴 하지만, 일부에서는 간섬유화를 평가하는 방법으로 침습적 인간 조직검사 대신에 비침습적인 방법인 간탄력도검사를 제안하고 있다[7,8,16].
초음파검사는 수십 년 전부터 간경변증 환자의 치료를 결정하고 추적관찰하는데 널리 사용되었다[17-26]. 간경변증과 관련된 초음파 소견은 결절성 표면, 거친 에코질감, 간용적의 재배치 등이 있다. Lu 등[27]은 간피막의 두께, 우엽의 최대장경, 비장 정맥의 지름, 비장의 두께의 초음파 소견과 간섬유화 정도가 유의하다고 보고하였으며, Nishiura 등[26]은 변연부의 둔화, 결절성 간표면, 거친 에코질감이 간 조직검사의 섬유화 정도와 상관관계가 있음을 보고하였다. Moon 등[9]은 초음파로 간표면 요철 정도, 간실질 에코 변화, 간우엽위축 정도, 비장종대 여부, 비장 정맥의 굵기, 간정맥파형의 존재 유무 등을 이용한 초음파점수 체계(ultrasonographic scoring system, USSS)가 간조직의 섬유화와 높은 상관관계가 있음을 보고하였다.
본 논문에서는 간 조직검사로 알코올성 간경변증을 확진한 환자에서 간경변증을 진단하는데 있어서 변형된 초음파점수체계(modified USSS, mUSSS)의 유용성을 간탄력도검사(LSM)와 비교하여 평가해보고자 한다.
대상 및 방법
대상
2007년 10월부터 2011년 2월까지 바이러스 및 약물 등의 원인 없이 알코올이 원인인 만성 간질환 또는 간경변증으로 입원한 19세 이상의 환자를 대상으로 하였다. 혈역학적 및 임상적으로 안정된 후 복부 초음파를 시행하였으며, 1주일 이내에 간 조직검사를 시행하였다. 만성 간질환 또는 간경변증이 의심되어 간 조직검사를 시행한 230명의 환자 중에서 연구 조건에 합당한 105명의 환자를 대상으로 연구하였다.
연구제외 기준은 복수나 간뇌증을 동반한 비대상성 간경화증 환자, 간 조직검사에서 진단에 부적절한 조직검체를 얻은 환자, 승압제를 필요로 하는 쇼크 환자, 자발성 세균성 복막염과 같은 조절되지 않는 감염질환을 가지고 있는 환자, 약물 또는 신장 원인 등 기타 원인에 의한 급성 신기능 부전을 가지고 있는 환자, 심혈관질환 또는 악성 고혈압을 가지고 있는 환자, 간세포암을 포함한 종양 환자, 정신과적인 문제를 가지고 있는 환자, 수유 기간 중인 여성 또는 임산부, 혈중 크레아티닌이 6 mg/dL 이상으로 상승한 환자였다.
방법
연구대상이 된 모든 환자에서 나이, 성별, 키, 몸무게, 체질량 지수(body mass index, BMI), Child class, 식도정맥류 출혈 병력 등을 조사하였으며, 혈액검사로 알부민(albumin), 빌리루빈(total bilirubin), 프로트롬빈 시간(prothrombin time), 혈소판수치(platelet)를 측정하였고, Model for End-Stage Liver Disease (MELD) 점수 측정, Age, Bilirubin, INR, Creatinine (ABIC)점수 측정, 간섬유화스캔을 이용한 간탄력도 측정, 복부 초음파 점수화 항목 측정(간표면 요철 정도, 간실질 에코 변화, 간우엽위축 정도, 비장종대 여부, 비장정맥의 굵기)을 시행하였다(Table 1). 모든 환자들은 2가지 비침습적인 방법으로 간섬유화를 측정하였다: 3.5-MHz의 M 탐촉자로 간섬유화스캔(Fibroscan; Echosens, Paris, France)을 시행하였으며, 3.5-MHz의 곡면 탐촉자로 복부 초음파(Prosound α10; Aloka, Tokyo, Japan)를 시행하였다.
복부 초음파검사, 간탄력도 측정검사 및 통계학적 자료수집은 이에 대한 지식과 경험이 풍부한 저자들에 의해 전향적으로 이루어졌으며, Table 1과 같이 복부 초음파 점수화 항목을 종합하여 변형된 초음파점수체계(mUSSS)를 수집하였다.
간 조직검사 결과는 간 분야에 경험과 지식이 풍부한 병리학 전문의가 판독을 하였으며, METAVIR 점수 시스템[28] (F0: lack of fibrosis, F1: portal fibrosis, F2: periportal fibrosis, F3: bridging fibrosis, F4: cirrhosis)에서 간경변증에 해당하는 F4단계를 Laennec 섬유화 점수 시스템[29]을 이용하여 F4a (경도 간경변증, mild cirrhosis), F4b (중등도 간경변증, moderate cirrhosis), F4c (중도 간경변증, severe cirrhosis)로 세분화하였다.
통계학적 분석
통계프로그램은 SPSS version 18.0 (SPSS Inc., Chicago, IL, USA)를 사용하였다. 범주형 변수분석에는 x2 test와 Linear-by-Linear association를 사용하였으며, 연속형 변수분석에는 Student t-test를 사용하였다. 간경변증에 대한 변형된 초음파 점수화 시스템(mUSSS)과 간탄력도검사(LSM)의 진단적 가치를 알아보기 위해 receiver-operating characteristic (ROC) 곡선을 이용하였다. p수치가 0.05 미만일 때 통계학적으로 유의하다고 판단하였다.
결 과
환자 특성
105명의 환자 중에서 남성이 96명, 여성이 9명으로 남성의 비율이 높았으며 전체 평균 연령은 50.5 ± 10.0세였다. Laennec 섬유화 단계로 분류하여 F0-3의 비-간경화(non-cirrhosis)군과 F4의 간경화(cirrhosis)군을 비교하였을 때, 프로트롬빈 시간, 12만 개 미만의 혈소판수치, 식도정맥류 과거력, 변형된 초음파점수체계(mUSSS), 간탄력도검사(LSM)에서 각각 p = 0.002, p < 0.001, p = 0.010, p < 0.001, p < 0.001로 통계학적으로 유의한 차이를 보였다. 그러나 간경화군과 비-간경화군 사이에 체질량 지수(BMI), 알부민 수치, 빌리루빈 수치는 통계학적으로 유의한 차이를 보이지 않았으며, 알코올성 간염의 예후인자 모델에서 MELD와 ABIC도 두 군 사이에서 통계학적으로 유의한 차이를 보이지 않았다(Table 2).
Laennec 섬유화 단계에 따른 변형된 초음파점수체계(mUSSS)와 간탄력도검사(LSM) 결과
Laennec 섬유화 단계(F0: lack of fibrosis, F1: portal fibrosis, F2: periportal fibrosis, F3: bridging fibrosis, F4a: mild cirrhosis, F4b: moderate cirrhosis, F4c: severe cirrhosis)에 따른 변형된 초음파점수체계(mUSSS)는 F0에서 3.5점, F1에서 3.3점, F2에서 4.6점, F3에서 5.1점, F4a에서 5.8점, F4b에서 6.3점 그리고 F4c에서 7.0점으로 F1을 제외하고 간섬유화가 진행함에 따라서 증가하는 경향이었다(Fig. 1A).
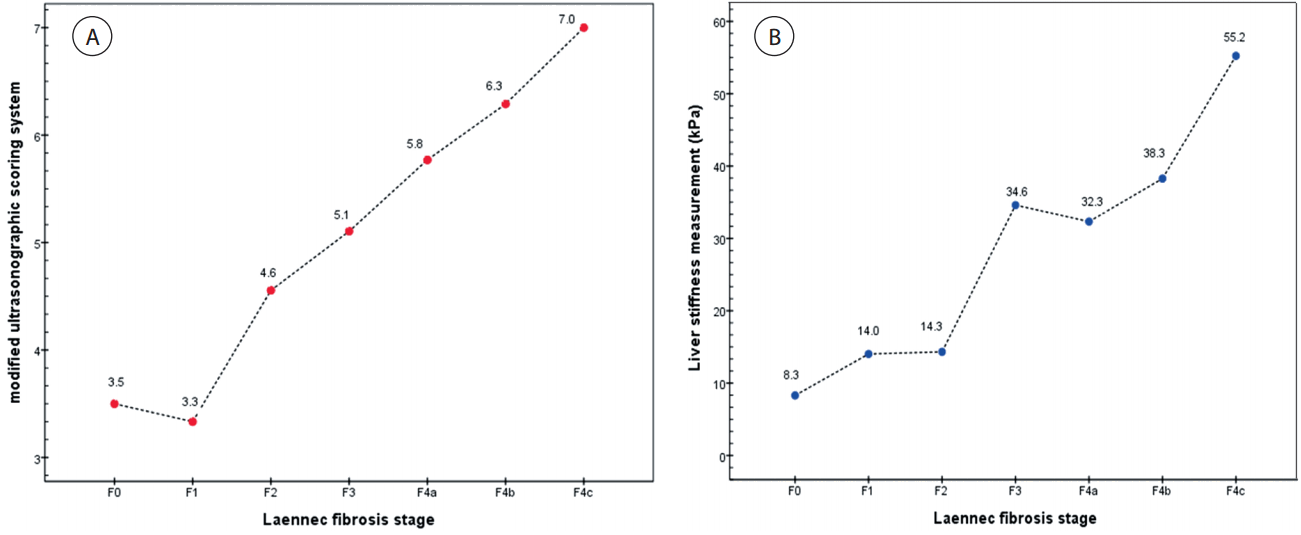
(A) Modified ultrasonographic scoring system (mUSSS) for each Leannec fibrosis stage. The mean value of mUSSS were 3.5 for F0, 3.3 for F1, 4.6 for F2, 5.1 for F3, 5.8 for F4a, 6.3 for F4b, and 7.0 for F4c. According to advancing Laennec fibrosis stage, the mean value of mUSSS increased (p < 0.001). (B) Liver stiffness measurement (LSM) for each Leannec fibrosis stage. The mean value of LSM were 8.3 for F0, 14.0 for F1, 14.3 for F2, 34.6 for F3, 32.3 for F4a, 38.3 for F4b, and 55.2 for F4c. According to advancing Laennec fibrosis stage, the mean value of LSM increased except F4a (p < 0.001).
간탄력도검사(LSM)의 경우에는 F0에서 8.3 kPa, F1에서 14.0 kPa, F2에서 14.3 kPa, F3에서 34.6 kPa, F4a에서 32.3 kPa, F4b에서 38.3 kPa 그리고 F4c에서 55.2 kPa로 F4a를 제외하고 간섬유화가 진행함에 따라서 증가하는 경향이었다(Fig. 1B).
간경변증(F4a-F4c: mild-severe cirrhosis) 진단시 변형된 초음파점수체계(mUSSS)와 간탄력도검사(LSM)의 비교
METAVIR 시스템[28]의 간경변증(F4)은 Laennec 섬유화 단계[29]의 F4a-F4c로 세분화할 수 있다. 간경변증(F4, F4a-F4c) 진단 시에 변형된 초음파점수체계(mUSSS)의 AUROC는 0.822 (95% confidence interval [CI] 0.736-0.907)로 간탄력도검사(LSM)의 AUROC인 0.733 (95% CI 0.625-0.840)보다 높게 분석되었다.(Fig. 2).

Receiver operating characteristic (ROC) curves of modified ultrasonographic scoring system (mUSSS) and liver stiffness measurement (LSM) in diagnosis of mild-severe cirrhosis (F4a-F4c) in Laennec fibrosis stage. The areas under the ROC curves of mUSSS and LSM were 0.822 (95% confidence interval [CI] 0.736-0.907) and 0.733 (95% CI 0.625-0.840), respectively.
분석된 ROC 곡선을 토대로 변형된 초음파점수체계(mUSSS)의 절단값(cut off value)은 5점 이상이었으며, 민감도(sensitivity), 특이도(specificity), 양성예측도(positive predictive value), 음성예측도(negative predictive value), 양성우도비율(positive likelihood ratio), 음성우도비율(negative likelihood ratio) 그리고 정확도(accuracy)는 각각 0.957, 0.429, 0.770, 0.833, 1.675, 0.100 그리고 0.781로 분석되었다(Table 3).
중등도-중도 간경변증(F4b-F4c: moderate-severe cirrhosis) 진단시 변형된 초음파점수체계(mUSSS)와 간탄력도검사(LSM)의 비교
중등도-중도 간경변증(F4b-F4c) 진단 시에 변형된 초음파점수체계(mUSSS)의 AUROC는 0.803 (95% CI 0.717-0.890)으로 간탄력도검사(LSM)의 AUROC인 0.754 (95% CI 0.656-0.853)보다 높게 분석되었다(Fig. 3).

Receiver operating characteristic (ROC) curves of modified ultrasonographic scoring system (mUSSS) and liver stiffness measurement (LSM) in diagnosis of moderate-severe cirrhosis (F4b-F4c) in Laennec fibrosis stage in Laennec fibrosis stage. The areas under the ROC curves of mUSSS and LSM were 0.803 (95% confidence interval [CI] 0.717-0.890) and 0.754 (95% CI 0.656-0.853), respectively.
분석된 ROC 곡선을 토대로 변형된 초음파점수체계(mUSSS)의 절단값(cut off value)은 6점 이상이었으며, 민감도(sensitivity), 특이도(specificity), 양성예측도(positive predictive value), 음성예측도(negative predictive value), 양성우도비율(positive likelihood ratio), 음성우도비율(negative likelihood ratio) 그리고 정확도(accuracy)는 각각 0.807, 0.708, 0.767, 0.756, 2.767, 0.272 그리고 0.762로 분석되었다(Table 4).
중도 간경변증(F4c: severe cirrhosis) 진단시 변형된 초음파점수체계(mUSSS)와 간탄력도검사(LSM)의 비교
중도 간경변증(F4c) 진단 시에 변형된 초음파점수체계(mUSSS)의 AUROC는 0.759 (95% CI 0.651-0.868)로 간탄력도검사(LSM)의 AUROC인 0.777 (95% CI 0.669-0.886)보다 낮게 분석되었다(Fig. 4).
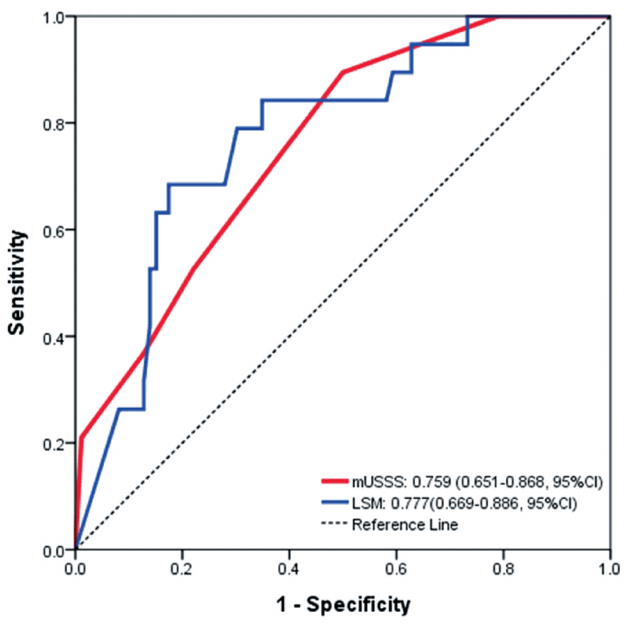
Receiver operating characteristic (ROC) curves of modified ultrasonographic scoring system (mUSSS) and liver stiffness measurement (LSM) in diagnosis of severe cirrhosis (F4c) in Laennec fibrosis stage in Laennec fibrosis stage. The areas under the ROC curves of mUSSS and LSM were 0.759 (95% confidence interval [CI] 0.651-0.868) and 0.777 (95% CI 0.669-0.886), respectively.
분석된 ROC 곡선을 토대로 변형된 초음파점수체계(mUSSS)의 절단값(cut off value)은 6점 이상이었으며, 민감도(sensitivity), 특이도(specificity), 양성예측도(positive predictive value), 음성예측도(negative predictive value), 양성우도비율(positive likelihood ratio), 음성우도비율(negative likelihood ratio) 그리고 정확도(accuracy)는 각각 0.895, 0.500, 2.833, 0.956, 1.789, 0.211 그리고 0.571로 분석되었다(Table 5).
고 찰
우리나라는 간질환, 특히 간경변증의 유병률이 높으며, 통계청 자료에 따르면 2008년도와 2009년도의 인구 10만 명 당 17.3명과 15.6명으로 사망률 6, 7위를 차지하고 있다. 간경변증을 확진하고 섬유화 정도를 평가하기 위해서는 간생검에 의한 조직검사가 반드시 필요하다고 알려져 있다[3]. 그러나 이는 침습적인 검사이며 빈도는 낮지만 사망 등의 합병증이 있을 수 있기 때문에[5], 비침습적인 간섬유화 평가방법들의 개발이 시도되어 왔다[30].
비침습적인 방법인 간섬유화스캔을 이용한 간탄력도검사는 간섬유화와 유의한 연관성이 있으며[11], 최근에는 만성 간질환에서 간 조직검사를 대신할 수 있는 안전한 방법이라고 여겨진다[6]. Berzigotti 등[31]에 따르면 간경변증을 예측하는데 초음파보다 더 뛰어나다고 하였다. 그러나 염증이 심한 경우와 지방증(steatosis)이 심한 경우, 갈비뼈 사이 공간이 좁아서 탐촉자를 고정시키기 어려운 경우, 복수가 동반되어 있거나 간효소수치가 상승된 경우에도 정확한 검사를 할 수 없게 된다[6,32-35]. 또한 간탄력도검사는 음식물을 섭취한 경우와 호흡 주기에도 영향을 받기 때문에 결과 판독시에 주의를 요한다[36,37].
초음파는 반 세기 이상의 기간 동안 사용되었기 때문에 임상 의사에게 익숙하고[38], 비침습적인 방법으로 효과적인 영상을 얻을 수 있어 환자의 순응도(compliance)가 높으며[39], 생체 징후(vital signs)가 불안정한 환자의 경우에도 이동하지 않고 침대 옆(bedside)에서 검사를 진행할 수 있다. 또한 초음파 기기는 1차 의료기관을 포함한 많은 의료기관에서 이미 사용하고 있으므로 간섬유화를 진단하기 위하여 새로운 기기를 추가로 구입해야 하는 비용 부담도 없다. 이러한 많은 장점들로 인해서 초음파는 간질환 환자를 진단하고 추적관찰하는데 가장 흔하고 비교적 쉽게 사용 가능한 도구가 되었다. 이전 연구들[9,26,27]에서 간표면 요철 정도, 간실질 에코 변화, 간우엽위축 정도, 비장종대 여부, 비장정맥의 굵기, 간정맥파형의 존재 유무 등의 초음파 항목들을 이용하여 간섬유화를 예측하고 간경화를 진단하였다.
저자들은 우리나라의 의료현실을 감안하여, 1차 의료기관에서도 임상 의사가 간질환 환자를 진찰할 때 비교적 간단하게 사용할 수 있도록 도플러 지표를 제외하여 초음파점수체계[9]를 변형하였다.
경도 이상의 간경변증(F4, F4a-F4c) 및 중등도 이상의 간경변증(F4b-F4c) 진단에 있어, 변형된 초음파점수화시스템(mUSSS)의 AUROC 값이 간탄력도검사(LSM)의 AUROC 값보다 높았다(F4a-F4c, 0.822 vs. 0.733: F4b-F4c, 0.803 vs, 0.754) (Figs. 2 and 3). 경도 이상의 간경변증 및 중등도 이상의 간경변증 진단 시에 변형된 초음파점수체계(mUSSS)가 간탄력도검사(LSM)보다 더 유용하다고 해석할 수 있다. 임상적으로 간경변증이 의심된다면 초음파를 이용하여 간섬유화를 예측하고 중도 간경변증(severe cirrhosis)으로 진행할 수 있는 경도-중등도 간경변증(moderate-severe cirrhosis) 환자를 조기 선별하여 합병증을 최소화하는데 도움이 될 것이라고 생각한다.
중도 간경변증(F4c) 진단시, 변형된 초음파점수체계(mUSSS)의 AUROC 값이 간탄력도검사(LSM)의 AUROC 값보다 낮았다(0.759 vs. 0.777) (Fig. 4). 중도 간경변증(severe cirrhosis) 환자의 경우 이미 합병증이 진행되어 있는 비대상성 간경변증 환자가 많기 때문에 별다른 진단기법이 없이도 쉽게 간경변증 여부를 진단할 수 있으므로 저자들이 제시한 점수법은 중도 간경화의 경우 임상에서 유용성이 떨어질 것이라고 생각된다.
본 논문은 알코올성 간질환 원인으로 임상적으로 간경변증이 의심되는 환자들을 대상으로 한 연구로서 균일한(homogeneous) 연구대상으로 시행한 연구라는 점에서 의의가 있다. 그러나 우리나라 간경변증 환자의 원인질환은 B형 간염 바이러스에 의한 만성 간질환이 48-70%로 가장 많고 알코올성 혹은 C형 간염 바이러스에 의한 경우가 다음 순위를 차지하기 때문에, 이는 본 논문의 제한점이라고 할 수 있다. B형 간염 바이러스에 의한 간경변증 환자에 대한 추가 연구가 필요하다.
결론적으로 본 연구를 통하여, 변형된 초음파점수체계(mUSSS)는 간탄력도검사(LSM)와 더불어 초기 단계의 간경변증을 조기에 진단하는데 유용함을 알 수 있다.