초음파 최신 기법을 이용한 간 종괴의 감별진단: 조영제 초음파 검사와 초해상도 초음파의 활용
New Ultrasonographic Techniques to Differentiate Hepatic Masses: Contrast-Enhanced Ultrasound and Super-Resolution Ultrasound
Article information
Abstract
조영제 초음파 검사와 초해상도 초음파 검사는 최신 초음파 기법들로 간세포암을 비롯한 간 종괴의 감별진단에 도움이 된다. 특히 소나조이드 조영제 초음파는 쿠퍼기 영상을 통해 간세포암의 진단 민감도를 높일 수 있으며, 더 많은 조기 간세포암을 발견하여 치료할 수 있도록 한다. 초해상도 초음파 검사는 조영제 없이도 종양 혈류를 관찰할 수 있으며 특히 국소 결절성 과증식증의 바퀴살 모양 혈류를 관찰하는 데 있어 조영제 초음파와 동등한 진단 능력을 보인다.
Trans Abstract
Contrast-enhanced ultrasound (CEUS) and super-resolution ultrasound (US) are novel ultrasound technologies for differentiating hepatic masses including hepatocellular carcinoma (HCC). Kupffer-phase imaging on Sonazoid CEUS can increase the diagnostic sensitivity for HCC, and facilitates early identification and treatment of HCC. On the other hand, super-resolution US can depict intratumoral vascularity without contrast enhancement, and its diagnostic performance for identifying the spoke-wheel pattern of focal nodular hyperplasia is equivalent to that of CEUS.
서 론
초음파 검사는 비교적 안전하고 검사가 간편하여 간질환을 비롯한 여러 장기의 질병에 대한 일차 진단 도구로 널리 활용되어 왔다[1-4]. 간 초음파 검사의 경우, 간세포암 발생 위험이 있는 간경변, 만성 간염 환자를 대상으로 간세포암의 감시 검사로도 널리 활용되고 있다[5]. 하지만 간 초음파 검사의 단점으로는 검사자의 검사 경험과 지식에 진단 정확도에 차이가 있을 수 있다는 점과 폐 또는 대장 안의 공기가 초음파의 투과를 방해하여 검사 범위에 제한이 생긴다는 단점이 있으며, 또한 전산화단층촬영(computed tomography, CT), 자기공명영상(magnetic resonance imaging, MRI) 검사와는 달리 조영제를 사용하여 간 종괴의 조영증강 여부 등 형태학적 특성을 검사하기 어려워 최종 진단을 내리기 어렵다는 제한점이 있다.
이를 극복하기 위해, 최신 초음파 기법들이 도입되었는데, 예를 들어 초음파 검사를 위한 정맥 내 조영제라던가 기존 컬러 도플러 검사의 단점을 극복하고 미세혈류 발견에 더 민감하도록 개발한 초해상도 초음파 검사(super-resolution ultrasonography) 기법이 있다. 이러한 검사를 통하여 회색조 초음파 검사에서 발견된 간 종괴에 대하여 조영증강 여부나 종양 내 혈관의 관찰을 통한 감별진단이 가능해졌다.
본 종설을 통하여 초음파 최신 기법 중 소나조이드(Sonazoid; GE Healthcare, Oslo, Norway)를 활용한 조영제 초음파 검사와 초해상도 초음파 검사를 소개하고 임상적 활용에 대해 살펴보고자 한다.
본 론
조영제 초음파 검사
조영제 초음파 검사는 1996년에 처음 소개되어 심초음파, 혈관 초음파, 도플러, 복부 초음파 등에 활용되었다. 다른 조영제 영상 검사와는 달리, 신장이나 갑상선의 위험이 없고, 환자에게 편하다는 장점이 있었지만, 사용 준비가 까다로워 널리 활용되지 못하였다. 2001년에 낮은 역학적 지수(mechanical index)의 초음파를 이용하는 2세대 조영제 초음파가 개발되어 보급되면서 유럽, 일본 등지에서 간세포암과 같은 간종괴의 진단에 널리 활용되기 시작하였고, 간세포암의 진단가이드라인에도 포함되었다[6].
조영제 초음파의 일반적인 원리
초음파 검사에 사용하는 초음파 조영제는 미세기포로 구성되어 있으며, 크기는 2-3 μm로 적혈구보다 작아 모세혈관을 통과할 수 있다. 하지만 미세기포는 혈장 내에서 흡수되기 쉬워 혈액 내에서의 안정성을 강화하기 위하여 인지질 피막과 같은 보호피막이 입혀져 있다. 미세기포의 조영증강 원리는 초음파를 받았을 때 미세기포가 공명하여 후방 산란의 증강으로 강한 반향 신호가 발생한다. 이를 탐촉자에서 획득하여 영상으로 변환하면, 미세기포가 위치하는 혈관계(미세혈관계를 포함한)의 조영증강을 보이게 된다[7].
일반적으로 조영제 초음파의 영상 소견은 다른 조영제 영상 검사와 유사하며, 동맥기, 문맥기, 지연기로 구분하여 영상 검사를 시행한다. 하지만 두 가지 큰 차이점이 있는데, 첫 번째는 조영증강을 실시간으로 관찰할 수 있기 때문에 CT 또는 MRI 관류 검사와 비슷한 점이 있다는 것이고, 두 번째는 CT, MRI 조영제와 달리 세포 외 공간으로의 확산이 일어나지 않고 혈관계 내에 존재한다는 점이다. 따라서 지연기 조영증강을 특징으로 하는 간담도암의 CT, MRI 지연기 영상 소견은 조영제 초음파에서는 보이지 않고, 천공된(punched-out) 것과 같이 매우 뚜렷한 저에코 영역으로 보인다. 앞으로 설명할 소나조이드는 다른 2세대 초음파 조영제와는 달리, 혈관계 내에 존재하는 대식세포(macrophage)에 탐식되는 특징을 보이는데, 이를 통해 간내 쿠퍼세포에 소나조이드가 탐식되는 정상 간실질과 쿠퍼세포의 결손으로 인하여 소나조이드 탐식이 잘 일어나지 않는 악성 간종양이 구별된다.
국내에서 사용 가능한 초음파 조영제: 소노뷰와 소나조이드
위에서 설명한 바와 같이 소노뷰(Sonovue, Bracco, Milan, Italy)와 소나조이드는 서로 다른 영상 특징을 보인다. 일반적으로 소노뷰는 더 낮은 역학적 지수의 초음파를 사용하며 배경 초음파 영상을 더욱 어둡게 하여 조영증강되는 구조물을 더 민감하게 관찰할 수 있다는 장점이 있으며, 따라서 미세혈관 구조의 관찰에 용이하다. 하지만 조영 지속시간이 짧은 단점이 있다. 국내에서는 미세혈관의 이상을 관찰하기 위한 적응증에 모두 적용할 수 있다. 반면에, 소나조이드는 상대적으로 더 높은 역학적 지수의 초음파를 사용하며, 미세기포가 초음파 검사 도중에 잘 깨지지 않아 지연기까지 영상 검사가 용이하며 쿠퍼기 영상을 얻을 수 있어 악성 간병변의 진단 민감도가 높다는 장점이 있지만, 상대적으로 간세포암 진단에 있어 특이도가 낮을 수 있고 소노뷰에 비해 근거 문헌이 적다는 단점이 있다. 현재 소나조이드에 대한 국내 식약처 허가사항은 간내 국소 병변의 진단에 활용할 수 있도록 규정되어 있다. 외국 연구 자료를 살펴보면 유방암의 감시림프절의 진단 등에도 활용하는 것으로 알려져 있어[8] 적응증의 확대가 필요한 실정이다.
조영제 초음파 검사 과정
초음파 조영제는 분말 형태로 제조되어 생리 식염수와 섞어서 주입 준비를 한다(Supplementary Video 1). 정해진 양의 생리 식염수를 가루 분말이 들어있는 유리병에 주입하여 에멀젼 형태로 만드는데, 정맥 주입 전에 충분히 흔들어서 혼탁한 용액이 유지되도록 하는 것이 관건이다. 따라서 너무 일찍 준비하면 두 성분이 분리되어 조영증강이 잘 되지 않을 수 있으니, 사용 직전에 준비하여야 한다. 소노뷰는 1회 주입 시 2.4 mL, 소나조이드는 체중 1 kg당 0.015 mL, 즉 60 kg 환자에게 0.9 mL의 혼합 용액을 주입하고 일정량의 생리식염수를 추가 주입하도록 설명서에 기재되어 있으며, 경우에 따라 재주사가 필요할 경우가 있으므로 남은 조영제는 검사가 끝날 때까지 우선 보관한다.
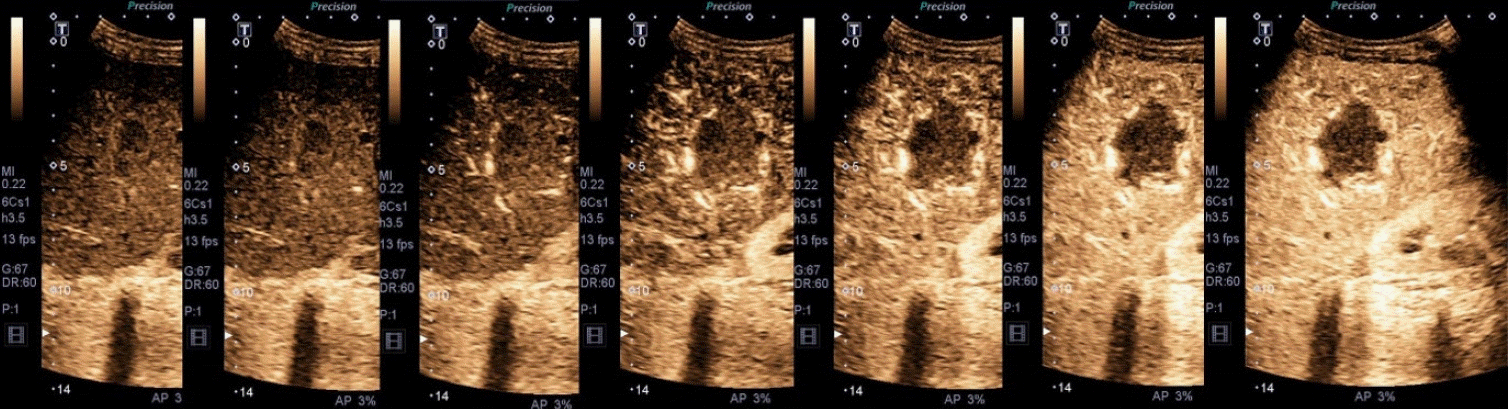
조영제 주입 후 투입 속도와 투입량, 환자의 혈액 순환시간에 따라 개인 차이가 있으며, 대개 소노뷰의 경우 10초 전후, 소나조이드의 경우 15초 전후에 간동맥 조영증강이 나타난다. 이때부터 30-45초까지 동맥기 영상을 획득하며, 이후 문맥기 영상을 획득하는데, 2분까지는 계속적인 관찰이 필요하다. 특히 1분 지연기의 영상 획득이 동맥기 다음으로 중요하며, 간세포암의 중요 소견인 약한 정도의 지연 씻김(mild and late washout)의 판단 근거가 되기 때문이다. 이후 2분부터 미세기포가 보이지 않을 때까지의 기간을 지연기로 부르며, 소나조이드의 경우에는 10분 후부터 쿠퍼기 영상을 획득한다(Fig. 1).
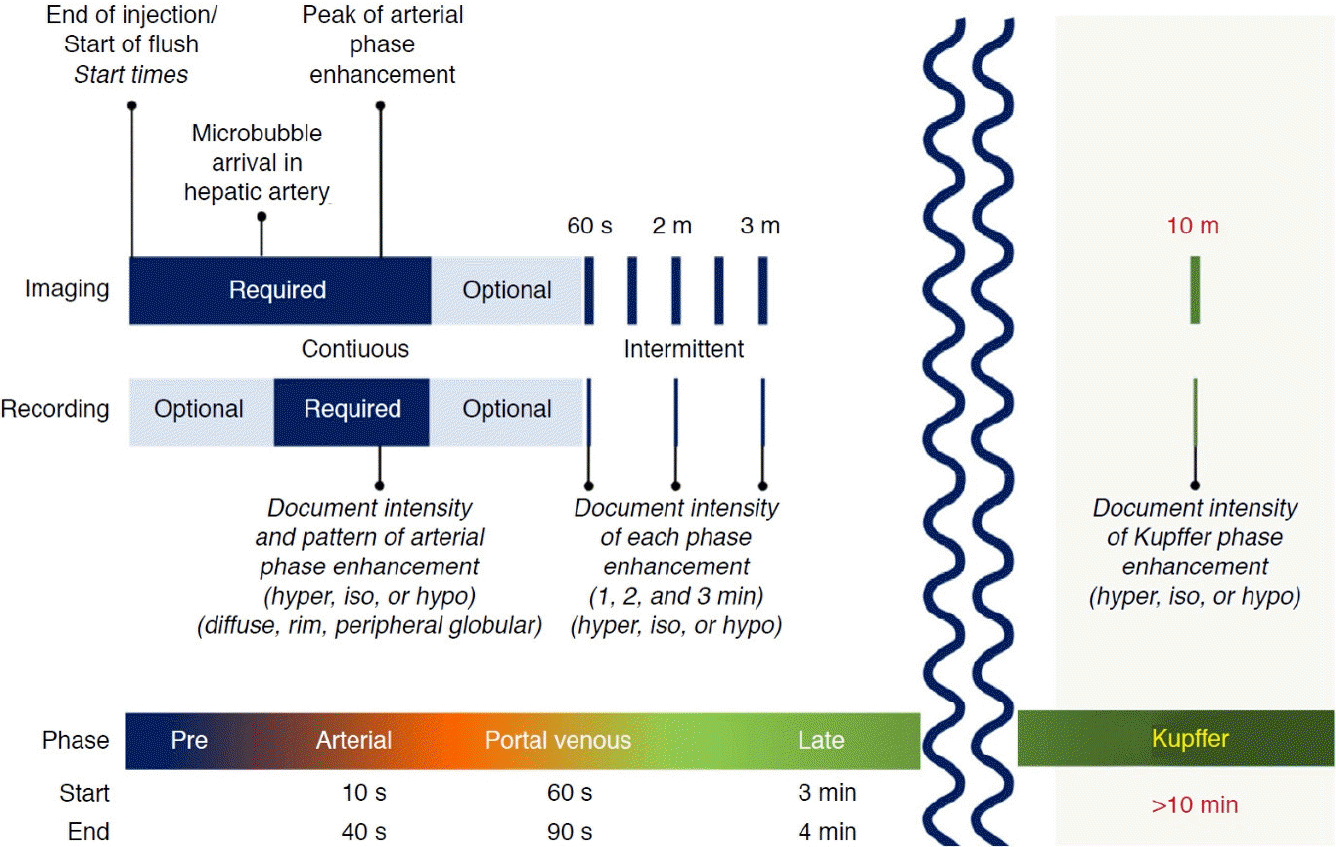
The imaging acquisition protocol for Sonazoid contrast-enhanced ultrasound. Reprinted from Hwang et al. [16] with permission from the Korean Society of Ultrasound in Medicine (KSUM).
초음파 조영제의 주입 금기증으로는 좌우단락 환자, 중증 폐성 고혈압 환자, 호흡곤란 환자가 있으며 조영제 배출이 폐를 통하여 일어나기 때문이다. 달걀 알러지의 병력이 있는 환자도 금기증에 해당하나 신중히 투여할 수 있으며, 우좌단락 환자의 경우, 큰 미세기포가 폐순환계에 걸러지지 않은 채 순환계로 유입되어 미세혈관의 폐색을 유발할 수 있기 때문이다. 중증의 심∙폐 질환 환자에게도 주의하여 투여해야 한다. 약물 이상 반응의 경우에는 다른 정맥 조영제와는 달리 드물며, 특히 아나필락시스 쇼크는 매우 드물다고 보고되었다. 가장 흔한 부작용은 소노뷰의 경우 두통, 소나조이드의 경우 두통 및 설사가 보고되었다.
초해상도 초음파 검사
초해상도 초음파 검사는 기존 파워 도플러 검사를 개선한 기술로, 저속 혈류에 대한 민감도를 높이기 위해, Canon의 Superb Microvascular Imaging, GE의 Micro Vascular Imaging, Philips의 Micro Flow Imaging, Samsung Medison의 Micro Vascular Flow와 같이 frame rate를 증가시키거나 특정 pulse sequencing 과 encoding, 혈관벽 움직임에 의한 불필요한 고강도 저속 신호를 clutter filtering으로 제거하는 등의 개발사 마다 다른 다양한 기술을 이용하고 있다[9]. 본 기술을 활용하면 혈관 굵기가 작은 저속 혈류의 관찰이 가능한데, 특징적인 종양 내 혈류 패턴을 갖는 국소 결절성 과증식증[10]이나 혈관종[11]의 종양 내 혈류를 관찰할 수 있고, 잘 알려진 간세포암의 바스켓 형태의 혈류 패턴도 볼 수 있다[12]. 따라서 조영제를 사용하지 않고 병변 내 혈관 구조를 자세히 볼 수 있다는 장점이 있지만, 동맥기 조영증강이나 씻김 현상과 같은 조영제 역동학적 평가를 할 수 없으므로, 병변의 정확한 진단을 위해서는 조영제 초음파 검사가 필요하다.
최신 기법을 이용한 간 종괴의 감별
간세포암
간세포암은 가장 흔한 원발성 악성 간 종양이며, 국내에 흔한 B형 간염 환자, 간경변 환자, 비알콜성 지방간염 등에서 발생한다. 국내에서는 간세포암의 조기 발견을 위해 위험군을 대상으로 간 초음파 검사를 주기적으로 시행하기를 권하며 국가 암 검진 프로그램에 포함되어 있다. 간세포암의 진단은 영상학적 검사를 기반으로 시행하며, CT, MRI에서의 특징적인 소견(동맥기 조영증강 및 문맥기, 지연기 씻김 현상)을 보이는 경우 간세포암으로 간주하고 조직 검사 없이도 치료를 진행할 수 있다. 조영제 초음파의 경우에도 특징적인 소견을 보이는 경우 간세포암을 진단할 수 있는데, 혈관 내에서만 존재하거나 쿠퍼세포에 탐식되는 미세기포의 특성 때문에 CT나 MRI와는 다른 영상의학적 특징을 보인다. 즉, 동맥기 과혈관성은 같지만, 바로 씻김 현상이 일어나지 않고 조영제 주입 후 1분 이후부터 약한 정도의 씻김(late and mild washout)이 나타나는 것이 간세포암의 전형적 소견이다(Fig. 2). 문맥종양혈전도 간세포암의 특징이며, 조영제 초음파 검사를 통하여 단순 혈전과 감별진단이 가능하다[13]. 미국영상의학회(American College of Radiology)에서는 조영제 초음파의 영상 소견의 표준화를 위해 contrast-enhanced ultrasound (CEUS) Liver Imaging Reporting and Data System (LI-RADS)을 도입하여 사용하고 있는데[14], 위에서 언급한 동맥기 과혈관성과 지연성의 약한 정도의 씻김을 보이는 경우 LR-5 단계의 간세포암 진단이 가능하다고 정하였으며, 주변부 조영증강을 보이거나, 조기 씻김 또는 현저한 씻김을 보이면 LR-M으로 간세포암의 특이적 소견을 아니지만 악성 간종양을 시사하는 소견으로 정리하였다. 주의할 점은 소나조이드 조영제 초음파의 경우 CEUS LI-RADS를 아직 적용할 수 없고 소노뷰와 같은 혈관풀 제제만 가능하다는 점이다. 초해상도 초음파 검사의 간세포암 소견은 바스켓 형태가 가장 많고, 종양 내 혈관 또는 두 가지 소견이 함께 관찰되기도 한다. 종양 혈류의 관찰 민감도는 58% 가량으로 컬러 도플러 검사(14%)보다 높다[12].
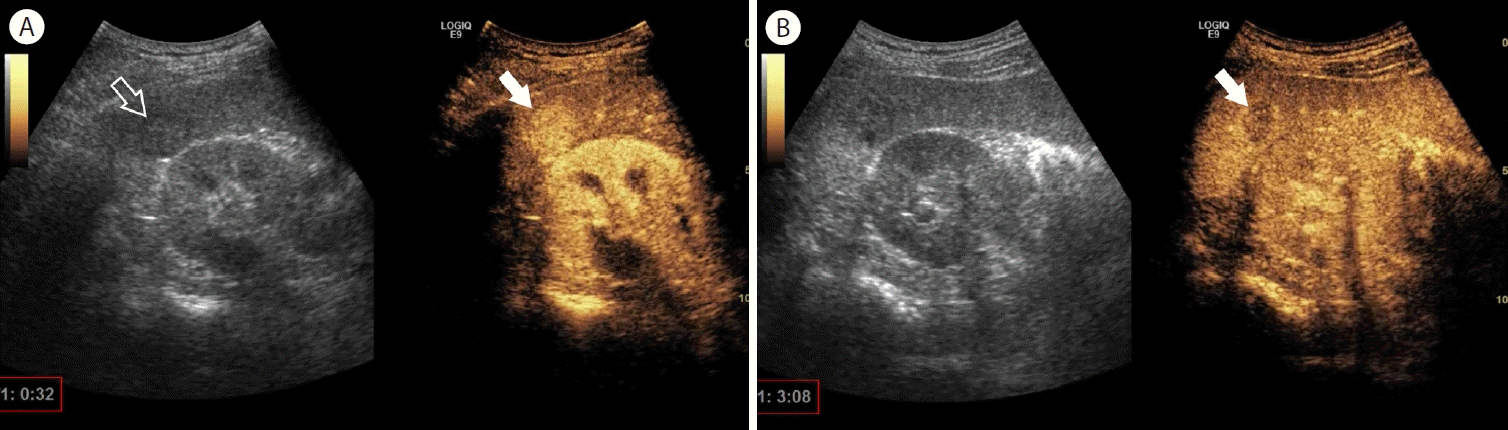
Arterial and delayed phases of Sonazoid contrast-enhanced ultrasound for hepatocellular carcinoma. In the arterial phase, a mass with hyper- enhancement (solid arrow) is seen in hepatic segment 6. A hypoechoic rim can be seen on the gray-scale image (open arrow), which is a characteristic of hepatocellular carcinoma (A). In the delayed phase, the mass is washed out (solid arrow) (B).
간담도암
간담도암은 두 번째로 흔한 원발성 악성 간 종양으로, 간세포암에 비해 대체로 예후가 더 좋지 않은 것으로 알려져 있다. 담도에서 발생하므로 간내 담도가 확장되는 경우가 많지만, 비교적 크기가 작은 간담도암은 담도 확장이 불분명하고 동맥기 조영증강을 보이는 결절로 나타나기도 하여 간세포암과의 감별진단이 필요한 경우가 있다. 간담도암의 조영제 초음파 소견으로는, 동맥기 조영증강 후 비교적 이른 시간에 조기 씻김 및 현저한 씻김 현상(early and marked washout)이 발생하며, 간세포암의 지연성 씻김 현상과 구별되는 점이다(Fig. 3). 또한 동맥기 조영증강도 테두리 조영증강을 보일 수 있지만, 특이적인 소견은 아니며, 간세포암에서도 보일 수 있는 소견이다.

Arterial and portal venous phases of Sonazoid contrast-enhanced ultrasound for cholangiocarcinoma. A lobulated mass with central necrosis is seen in the left hepatic lobe. Its peripheral portion is gradually enhanced (arrows) in the arterial phase (A). However, the enhanced area of the mass shows early and marked wash-out in the portal venous phase (B).
간전이암
간전이암은 간담도암과 비슷한 조영제 초음파 소견을 보이며, 동맥기에 주변부 조영증강을 보이는 경우가 많고, 조기 씻김 및 현저한 씻김 현상을 주로 보인다. 또한 다발성 병변으로 보이는 경우가 흔하고 대개 대장암과 같은 원발암을 인지한 채 검사하는 경우가 많다. 혈행성 전이가 많으므로 담도 확장은 비교적 흔하지 않으며, 간세포암과 같은 문맥종양혈전도 잘 동반하지 않는다.
양성 간 종괴: 국소 결절성 과증식증과 혈관종
국소 결절성 과증식증(focal nodular hyperplasia, FNH)은 드물게 볼 수 있는 양성 질환으로 주로 여성에서 호발하지만 남성에서도 종종 관찰된다. 국소 결절성 과증식증의 특징적 영상 소견으로는 중심부 반흔과 바퀴살 모양의 종괴 내 혈관을 들 수 있는데, 조영제 초음파 검사에서 이러한 특징적 소견을 확인할 수 있다(Fig. 4, Supplementary Videos 2, 3). 소나조이드 조영제 초음파의 경우에는 쿠퍼기 영상이 추가로 도움이 되는데, 국소 결절성 과증식증은 정상 간세포로 구성되어 있고 간정맥동 내부의 쿠퍼세포가 정상적으로 있기 때문에, 쿠퍼기 씻김 현상이 거의 일어나지 않고, 중심부 반흔에서만 일부 씻김을 볼 수 있다[15]. 이러한 소견을 통해 과혈관성 종양인 간세포암과의 감별진단에 도움이 된다. 초해상도 초음파 검사도 진단에 많은 도움이 되는데, 소나조이드 조영제 초음파 검사와 전향적으로 비교한 연구에 의하면, 바퀴살 모양의 혈류는 63%에서 발견되어 조영제 초음파의 71%와 비교하여 유의한 차이가 없었으며, 진단 신뢰도도 두 검사 간 동등하였다. 또한 검사자 간 일치도도 0.82로 상당히 높았다[10].
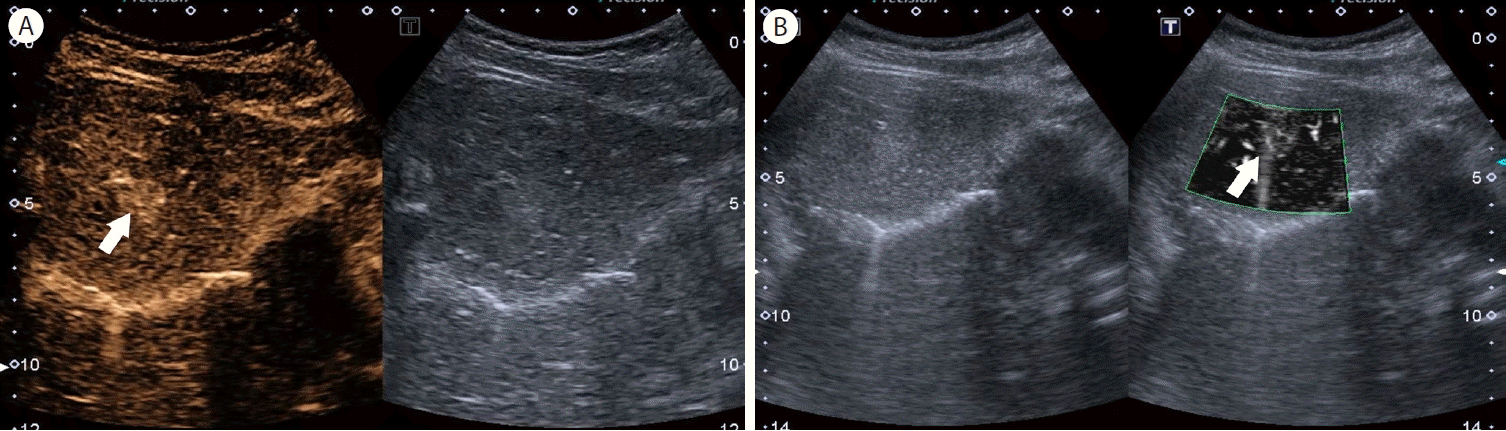
Sonazoid contrast-enhanced ultrasound (CEUS) and super-resolution ultrasound of focal nodular hyperplasia. In the arterial phase of CEUS, a radial vascular structure with a central artery (spoke-wheel appearance) is seen (arrow, A). Super-resolution ultrasound can also depict this structure well (arrow, B).
간혈관종은 매우 흔한 양성 간 종양으로 CT나 MRI와 마찬가지로 혈관종 변두리에 비연속적 결절성 조영증강을 보이며 시간이 지날수록 점차 조영증강 결절의 크기가 증가하면서 병변의 내부로 조영증강이 진행되는 구심성(centripetal)의 조영증강을 보인다(Fig. 5). 일부 간혈관종의 경우, 반지 모양의 조영증강을 보일 수 있어, 비특이적 간세포암이나 간담도암으로 오인될 수 있으므로 주의해야 한다. 대개 문맥기 및 지연기에서는 씻김 현상 없이 조영증강이 유지되지만, 소나조이드를 사용하는 경우, 지연기에서 실질보다 에코가 낮은 병변으로 보일 수 있고, 쿠퍼기에서도 주변보다 조영증강이 낮은 병변으로 보일 수 있지만, 일반적인 악성 병변보다는 내부 에코가 다소 높은 편이다. 이전 연구 결과를 보면, 컬러 도플러에서 혈관종의 종양 혈류가 잘 보이지 않는데 반해, 초해상도 초음파 검사의 경우, 67%의 혈관종에서 종양 혈류를 관찰할 수 있었고, 주변부 띠 형태의 혈류가 가장 흔하고, 점상의 굵어진 혈관을 포함하는 결절형 주변부 혈류가 그 다음으로 흔했다[11].
결 론
위에서 살펴본 바와 같이, 조영제 초음파 검사는 간 종괴의 감별진단에 도움이 되며, 특히 CT 및 MRI에서 진단이 다소 불확실한 경우, 영상 진단을 정확도를 높이는 데 도움이 된다. 초해상도 초음파 검사는 미세기포의 주입 없이도 종양 혈관의 형태적 특징을 보는 데 도움이 되며, 특히 국소 결절성 과증식증의 진단에 도움이 된다. 검사에 익숙해지기 위해서는 충분한 숙련도가 요구되기는 하지만 CT, MRI와 같은 고가 장비 없이 간 종괴의 혈류역동학적 소견을 토대로 진단할 수 있으므로 환자를 일차적으로 관찰하고 진단하는 의원급 의료기관에서도 많이 사용하기를 기대한다.