하복부 통증의 초음파 진단
Abstract
Lower abdominal pain is one of the most common symptoms prompting patients to visit hospitals. It can be caused mainly by gastrointestinal diseases such as appendicitis, an appendiceal tumor, diverticulitis, enterocolitis, epiploic appendagitis, Crohn’s disease, ulcerative colitis, and colon cancer. In case of lower abdominal pain in women of reproductive age, gynecological causes must always be considered. Distal ureteral stones must be ruled out in patients with lower abdominal pain and hematuria. Rectus sheath hematomas should be considered in patients with trauma, anticoagulants, or recent strenuous exercise. Correct and prompt diagnosis, primarily by imaging techniques such as abdominal ultrasonography (US), computed tomography (CT), and magnetic resonance imaging (MRI), is essential for the appropriate management of patients. As compared with CT or MRI, abdominal US is easily performed at the bedside, minimally invasive, and emits no ionizing radiation. Nonetheless, diagnostic sensitivity for lower abdominal disease, including appendicitis, is lower than with CT or MRI, so a complementary study may be performed if the diagnosis remains unclear.
Keywords: Ultrasonography; Appendicitis; Abdominal pain
중심 단어: 초음파; 충수염; 복통
서 론
하복부 통증의 원인 질환은 보존적인 치료로 호전되는 질환에서부터 응급 수술이 필요한 질환까지 다양하다. 특히 우하복부통증 환자에서 수술이 필요한 급성 충수염(acute appendicitis)의 유무를 확인하는 것이 중요하다. 그 외에도 하복부 통증을 유발하는 질환으로 대장 게실염(colonic diverticulitis), 감염성 장염(infectious enterocolitis), 대장암(colon cancer), 크론병(Crohn's disease)과 같은 위장관 질환, 장간막 림프절염(mesenteric lymphadenitis), 일차성 복막수염(epiploic appendagitis), 대망경색(omental infarction)과 같은 장관 주위의 장간막 질환과 비뇨기 질환 및 부인과 질환들이 있다( Table 1). 하복부 통증의 일차적인 원인 검사로써 초음파가 많이 활용되는데, 초음파검사법은 조영제 사용으로 인한 부작용이 없으며 역동적인 검사법으로써 검사 중 장의 연동을 관찰할 수 있고, 환자와 대화하면서 통증이 심한 부위를 집중적으로 검사할 수 있으며 방사선 노출이 없어 소아와 임산부에서 안전하게 사용할 수 있다. 하지만 초음파 검사법은 시술자의 능력에 따라서 진단율의 차이가 있고(operator dependent), 비만 환자의 경우 진단에 한계가 있는 단점이 있어서 반복적인 검사를 통하여 숙달되도록 노력해야 하며 필요시 복부전산화단층촬영(computed tomography) 등의 부가적인 검사를 통하여 정확한 진단을 하도록 한다. 특히 우하복부 통증 환자에서 진단이 애매한 경우 정상 충수를 초음파로 확인함으로써 급성 충수염을 배제할 수 있는 근거를 제공한다. 본고에서는 소화관 초음파의 기본 술기와 하복부 통증을 일으키는 원인 질환의 초음파 진단에 대하여 기술하려고 한다.
본 론
소화관 초음파의 특징
초음파검사에서 정상 소화관은 내부의 공기로 인하여 관찰하기 어렵지만 병변이 있을 때는 오히려 관찰이 용이하다( Figs. 1 and 2). 소화관 질환이 발생하면 소화관 벽의 비후와 층 구조의 변화, 내강의 확장, 혈류의 증가, 주위 지방조직의 침착, 림프절 종대 및 액체 저류가 발생함으로써 초음파검사에서 비교적 쉽게 관찰된다. 특히 소화관 벽 비후는 염증성 질환인 경우 초기에는 층 구조가 유지되지만 만성 염증이나 심한 염증 상태에서는 층 구조가 소실된다. 반면에 종양성 질환에서는 층 구조가 소실되는 것이 특징이다. 검사시에는 최대 통증 부위를 중심으로 관찰하는 것이 중요하고, 3-5 MHz의 저주파 탐촉자로 전체적인 소화관의 주행을 관찰한 이후 7-12 MHz의 고주파 탐촉자로 병변 부위(벽 구조)를 자세히 관찰한다. 그 외에도 점진적인 압박과 자세 변경 등의 기법을 이용하는 것이 중요하다.
소화관 초음파 검사의 기법
단계적 압박(graded compression, Fig. 3)
Puylaert [ 1]가 주창한 방법으로 탐촉자로 복부의 점진적인 압박을 통해서 탐촉자와 충수 사이에 있는 말단 회장 내의 가스를 밀어냄으로써 말단 회장과 우측 요근 사이에 있는 충수를 잘 관찰할 수 있는 방법이다. 압박을 가하는 강도는 환자의 체형에 따라서 다른데 마른 체형의 경우 약간의 압박만으로도 충수의 관찰이 가능하지만, 복부비만이 심한 경우 중증도 이상의 압박이 필요하다. 약간의 압박으로 충수가 관찰되지 않을 경우 조금씩 압박의 강도를 높이면서 관찰하는데, 주의할 점은 복통이 있는 환자의 경우 탐촉자의 급격한 조작은 환자의 몸이 경직되어 검사를 진행할 수 없는 경우가 있으므로 부드러운 조작이 필요하다. 하지만 우하복부의 장관이 잘 압박되지 않거나, 비만이 동반되거나 retrocecal appendix, deep pelvic appendix인 경우에는 점진적 압박법으로는 진단에 제한적일 수가 있어서 추가적인 기법을 사용함으로써 도움을 받을 수 있다.
Mowing the lawn technique (Fig. 4)
소장은 길이가 길어서 탐촉자로 전체 소장을 처음부터 끝까지 추적해서 검사하기가 불가능하므로 잔디 깎는 기계로 잔디를 깎듯이 상하로 탐촉자를 수직 방향으로 움직이면서 복부를 관찰하는 방법이다[ 2]. 만약 소장의 벽 비후나 종괴가 있는 경우에 병변을 관찰할 수 있다.
자세 변경(changing the position of the body, Fig. 5)
앙와위에서 점진적인 압박을 통해서 충수를 관찰할 수 없는 경우, 환자의 자세를 좌측 와위로 변경하면 말단 회장이 내측으로 이동하면서 이전에 보이지 않았던 환자의 일부에서 관찰될 수 있다. 이 경우 대부분 subcecal, retrocecal appendix가 해당된다. 특히 retrocecal appendix의 경우, 앙와위에서는 맹장 내의 가스로 인하여 그 후방이 잘 관찰되지 않는데, 좌측와위로 자세 변경 후 우측 옆구리를 음향창으로 접근하면 맹장 내의 가스나 분변을 우회할 수 있으므로 충수의 관찰이 용이해진다.
저주파 탐촉자의 활용(use of low frequency transducer, Fig. 6)
일반적으로 고주파 탐촉자의 경우 근접 영상을 선명하게 보여주지만 초음파의 투과가 깊숙이 되지 않는 단점이 있다. Deep pelvic appendix의 경우 고주파 선형 탐촉자로는 충수의 관찰이 어려운 반면 저주파 볼록형 탐촉자로 관찰하면 깊은 부위의 병변을 관찰할 수 있다. 또한 천공성 충수염의 경우 충수 내강은 보이지 않고 골반 내에 농양이나 액체 저류만이 있는 경우가 있는데 저주파 탐촉자로 쉽게 관찰되어 진단에 도움을 줄 수 있다. 그 외에 저주파 볼록형 탐촉자가 도움이 되는 경우가 있는데 우측하부 요로결석으로 인한 우하복부통증 환자에서 우측 신장의 수신증 여부를 관찰함으로써 진단에 도움을 줄 수 있고, 여성의 경우 우측 난소의 병변으로 인한 우하복부 통증의 경우 진단에 도움을 줄 수 있다.
대표적인 하복부 질환들
급성 충수염
급성 충수염의 초음파 소견[3-5] (Fig. 7)
1. 최대 전후 직경(maximal outer diameter)이 6 mm 이상이다.
2. 최대 벽 두께(maximal mural thickness)가 3 mm 이상이다.
3. 탐촉자로 압박시 압박되지 않는다.
4. 충수 분석(appendicolith)이 관찰된다.
5. 충수 주변의 고에코성 지방조직이 관찰된다.
6. Doppler 혈류검사상 충수 벽과 충수 주위 조직의 혈류 증가 소견이 있다.
7. 충수 주위 농양 소견이 관찰된다.
8. 장간막 림프절 종대가 관찰된다.
9. 맹장 벽의 비후가 관찰된다.
충수염의 다양한 종류
급성 화농성 충수염(acute suppurative appendicitis, Fig. 8)
호중구가 점막층과 근육층에 현저히 침착되고 점막 미란이 진행되어서 충수벽의 전층의 염증으로 내강은 화농성 삼출물로 차고 장액층 밖으로 삼출물이 두껍게 덮이는 경우를 급성 화농성 충수염이라고 하며, 초음파 소견은 1) 불명확한 층 구조, 2) 중증도로 늘어난 충수직경, 3) 제2층 점막고유층의 소실 또는 두께의 감소, 4) 점막하층이 두께 증가, 5) Doppler 혈류검사에서 충수벽과 충수 주위의 혈류 증가 소견 등이다[ 6].
급성 괴저성 충수염(acute gangrenous appendicitis, Fig. 9)
화농성 충수염에서 충수내강의 압력이 지속적으로 증가되면 허혈성 변화가 심해지면서 충수벽 전층의 궤사가 온 경우를 말하며, 초음파 소견은 1) 고에코 점막하층의 국소적 또는 전층의 단락, 2) 농양을 시사하는 국소적인 액체 저류(localized fluid collection), 3) Doppler 혈류검사에서 충수벽 혈류의 감소 또는 소실이 특징이다[ 7].
국소성 충수염(focal appendicitis, Fig. 10)
충수의 기시 부위에서 3 cm까지의 근위부 충수는 정상이면서 그 이하 부위의 폐색이 있는 경우를 말하며 급성 충수염 환자의 5-20%를 차지한다[ 8]. 이 경우 근위부에는 정상적인 충수의 모양을 보이므로 반드시 충수의 전장을 관찰할 수 있어야 한다. 임상적으로 우하복부 압통을 호소하는 환자에서 반드시 충수의 전장을 반드시 확인하여야 위음성을 줄일 수 있다.
후맹장 충수염(retrocecal appendicitis, Fig. 11)
후맹장 충수염은 우측 옆구리 통증과 같이 임상 양상이 비전형적인 경우가 많으며, 초음파검사에서 앙와위에서 적절한 압박을 하더라도 관찰할 수 없는 경우가 있어 좌측와위로 자세를 변경한 후 우측 옆구리에서 관상영상(coronal view)으로 검사하면 맹장 내의 가스를 우회해서 충수를 관찰할 수 있다. 이 경우 화면의 좌측에 충수의 선단부가 위치한다[ 9].
천공성 충수염(perforated appendicitis, Fig. 12)
충수벽의 괴저성 궤양이 심한 부위에서 천공이 일어나게 되면 충수의 내강은 허탈되어 종대된 충수가 보이지 않게 된다. 이 경우 환자의 복통이 감소하는 경향이 있으므로 진단에 주의를 요한다. 초음파에서 충수 주위의 고에코성 지방조직, 충수 주위의 액체 저류, 농양, 점막하층 전층의 소실과 장액층의 단락 등을 관찰하는 것이 중요하다[ 10].
충수점액낭종(mucocele of appendix, Fig. 13)
충수에 발생하는 종양으로써 충수 내에 비정상적인 점액성 물질이 가득 차서 팽창된 것을 말하며 절제된 충수의 0.2-0.3%에서 발생하는 아주 드문 질환이다. 충수점액낭종의 약 25%에서는 무증상이며 다른 원인으로 개복술을 시행할 때 또는 대장경 등과 같은 검사 시 우연히 발견된다. 대장경검사에서는 충수 입구에 상피하 종양 모양의 내강으로의 돌출과 중심부에 충수의 개구부가 관찰된다(volcano sign). Higa 등[ 11]의 분류에 의하면 병리학적으로 점막과형성, 점액성 낭선종, 점액성 낭종암 등 3가지로 구분되며 이 중에서 점액성 낭선종이 50%로 가장 흔하다. 초음파 소견은 점액성 물질의 농도에 따라 균일한 무에코의 낭종이나 미세한 내부 에코를 가진 낭성 종괴 또는 고에코와 저에코가 혼합된 고형 종괴 등으로 다양하게 보인다. 또한 분비되는 점액의 비중의 차이로 인하여 양파 껍질 모양의 concentric echogenic layer 형태(onion skin appearance)를 보인다.
충수암(appendiceal cancer, Fig. 14)
원발성 충수 종양은 충수절제 환자의 0.5-1%의 빈도로 아주 낮게 보고되고 있고[ 12], 충수 종양의 30-50%에서 비종양성 충수염의 형태로 발현되어 수술 전 진단이 어렵다[ 9]. 유암종이 전체의 85%를 차지하고 그 외에 점액성 암, 선암, 림프종의 형태로 나타날 수 있다[ 12]. 초음파 소견은 비후된 충수벽의 두께가 충수내강의 직경보다 더 두껍고 비후된 점막하층과 고유근층이 융합되어 층 구분이 없는 불규칙하고 심한 저에코 병변으로 보인다.
맹장 게실염(cecal diverticulitis, Fig. 15)
맹장의 게실은 대부분 장벽의 전층이 외부로 돌출되는 진성 게실로써 게실의 입구에 분석이 막힘으로써 게실의 염증이 발생하게 되는데, 맹장 게실염을 포함한 우측 대장 게실염은 진단시 대부분 보존적인 요법으로 치료가 가능하기 때문에 우하복부 통증 환자에서 이 질환에 대한 초음파 소견과 더불어 정상 충수를 확인하는 것이 진단에 결정적인 역할을 한다. 게실염의 초음파 소견은 게실 주위 국소적인 대장벽의 비후, 장벽의 외부로 돌출하는 게실과 게실 내의 저에코의 염증성 병변, 게실 입구의 고에코의 분석과 후방음영, 게실 주변의 염증성 고에코 지방 병변 등이 있다[ 9]. 반면에 에스결장에 발생하는 게실염은 점막과 점막하층이 외부로 돌출되는 가성게실로써 천공과 농양의 형성의 빈도가 높아 수술적인 치료가 필요한 경우가 흔하다.
감염성 회맹장염(infectious ileocecitis, Fig. 16)
감염성 장염 중 회맹판 부위에 주로 염증이 생기는 것을 말하며, 특히 점막, 점막하층에 국한된 벽비후 소견이 관찰된다. 이 경우 일반적인 장염에서 보이는 설사가 거의 관찰되지 않고 우하복부 통증, 발열, 오심 등의 증상이 주가 되어 충수염과 감별이 어려운 경우가 있다. 예르시니아( Yersinia), 캄필로박터( Campylobacter), 살모넬라( Salmonella)에 의해서 주로 발생하며 원인균에 따라서 초음파 소견의 차이가 있다. 특히 예르시니아 장염의 경우 말단 회장, 맹장벽의 비후와 장간막 림프절 종대 소견이 저명하여 급성 충수염과 감별이 필요하다. 장염에 의해서 2차적으로 충수의 비후가 관찰될 수 있으나, 이때는 충수 부위의 압통이 없고 충수 주변의 염증성 고에코 병변, 충수벽 내의 Doppler 혈류 증가가 없는 것으로 감별할 수 있다[ 9].
허혈성 장염(ischemic colitis, Fig. 17)
허혈성 대장염은 주로 고령 환자에서 조직 혈류의 감소로 인하여 발생한다. 임상적으로 좌하복부에 갑작스러운 경련성 복통이 있다가 24시간 이내에 혈성설사가 나타나는 것이 특징적이다. 원인은 혈압저하, 동맥경화, 혈관염과 혈관 경련같은 혈관 인자와 만성 변비나 관장 등에 의한 장관내압 증가 및 장의 연동운동 등의 장관측 인자가 장관벽의 혈류 저하를 일으켜 허혈 상태를 유발하는 것으로 알려져 있다. 허혈성 대장염은 3군데의 watershed area에서 호발하는데 비장만곡(Griffith’s point), 직장-에스결장 접합부(Sudek’s point) 그리고 우측대장이며 직장은 침범하지 않는 것이 전형적이다. 허혈성 장염의 진단에 있어서 복부 초음파검사는 안전하게 병변의 침범 부위와 괴사의 중증도를 알 수 있다. 중증도에 따라서 두 가지 형태로 구분하는데, 일과성 형태(transient form)는 점막, 점막하층의 허혈성 변화로 가역적이며 괴저성 형태(gangrenous form)는 장벽 전층의 괴사가 오는 심한 형태이다[ 9]. 초음파 소견은 침범된 대장의 벽비후가 있고 이때 장벽의 층 구조는 일과성 형태의 경우 유지되나 괴저성 형태에서는 소실된다. Color Doppler 검사에서 괴사 정도에 따라서 차이가 나서 일과성 형태에서는 혈류가 유지되나 괴저성 형태에서는 소실된다. 그 외에도 대장벽 주위의 지방침착과 대장벽 외부로의 액체저류 등이 관찰될 수 있다.
크론병(Crohn's disease, Fig. 18)
크론병은 대부분 장기간 지속된 복통을 호소하지만 회맹부 크론병의 1/3에서는 급성 충수염과 유사한 급성 증상을 호소한다. 크론병은 장벽 전층의 염증(transmural inflammation), 깊은 궤양, skip area를 특징으로 하고 우측 결장과 말단 회장을 주로 침범한다. 초음파에서 급성기에는 염증으로 침범된 장관벽이 대개 5 mm 이상, 심한 경우에는 10 mm 이상으로 두꺼워지고 장관벽 전층이 영향을 받고 특히 점막하층과 근층이 불규칙하게 비후되고 층 구조가 불분명해진다. 주변 장간막의 염증이 동반되고 증식되어 고에코 종괴로 보이고(creeping fat sign) 장간막 림프절 종대를 동반할 수 있다. 만성기에는 섬유화로 정상층 구조가 소실된 저에코 벽비후로 관찰된다[ 9]. 크론병의 합병증으로 협착, 누공(fistula), 농양 형성 등이 있다. 초음파검사에서 저에코의 대장벽 비후가 있는 경우 Color Doppler 검사에서 혈류 증가가 있으면 활동성 질환을 의미하고 혈류 증가가 보이지 않으면 섬유화로 인한 소견으로 볼 수 있다.
궤양성 대장염(ulcerative colitis, Figs. 19 and 20)
궤양성 대장염은 연속적으로 직장에서 근위부로 침범하는 점막 또는 점막하층의 염증을 특징으로 하는 원인 불명의 만성 비특이적 염증성 장질환으로, 호전과 악화가 반복되는 혈성 설사와 대변 절박증 및 복통 등이 주 증상이다. 발병 연령은 20-40대의 연령에서 가장 빈도가 높다. 남녀비는 1:1.1-1.3으로 여성이 약간 더 많다. 병변의 범위 분류는 대장내시경검사 소견에 의한 몬트리올 분류 방법을 따라 직장염(항문연에서 15 cm 상방까지만 침범), 좌측 대장염(직장에서 비장만곡까지 침범) 그리고 광범위 대장염(비장만곡의 이상까지 침범)으로 분류한다.
궤양성 대장염에서 복부 초음파의 의의는 전 대장내시경검사를 시행할 수 없거나 금기인 경우에 에스결장경검사와 병합하여 시행함으로써 병변의 범위를 알 수 있다는 점이다. 경증인 경우 층 구조가 유지되나 심한 궤양성 장염의 경우에는 층 구조의 소실을 관찰할 수 있다. 이러한 소견은 비특이적으로 허혈성 장염, 감염성 장염과 구분이 어렵다. 궤양성 대장염에서의 복부 초음파는 크론병과는 달리 질병 활성도를 반영하지 못하지만 치료 방향 결정 시 질병의 침범 범위 평가에 도움을 줄 수 있다.
초음파검사에서 점막부종, 점상출혈 및 삼출물에 의한 저에코의 점막층, 점막하층의 비후(층 구조는 유지되는 경우), 점막면에 점상 또는 선상의 고에코 병변(궤양), 결장팽대의 소실, Color Doppler 검사에서 비후된 장관벽 내의 혈류 신호 증가 및 심한 경우 장벽 전층의 비후와 층 구조의 소실을 관찰할 수 있다.
장중첩증(intussusception, Fig. 21)
근위부 장관이 원위부 장관으로 유입되는 질환으로 95%가 소아에서 발생한다. 소아에서는 90%에서 유발점(lead point)이 없는 특발성인데 대부분 바이러스 감염에 의해서 종대된 회맹부와 말단 회장의 림프절의 종대가 유인이 되고 증상은 복부 종괴의 촉지, 복통, 구토 및 혈변 등이며 소아에선 생후 3개월에서 2세 사이에 호발한다. 성인에서는 90%에서 유발점이 있는데 대장에서는 악성 종양, 소장에서는 양성 종양이 흔한 원인이다. 성인에서는 소아에 비해서 장관의 직경이 크므로 완전 폐색보다는 간헐적 장 폐색으로 인한 만성적 복통과 구토를 주소로 내원하는 것이 대부분이다. 장중첩증은 침범된 장관의 위치에 따라서 크게 3가지로 구분하는데, 가장 흔한 형태는 회장-결장형이고 소장-소장형, 결장-결장형은 드물다. 장중첩증은 유입되는 근위부 장관인 감입부(내통, 내초, intussusceptum)와 유입된 장관을 받아들이는 원위부 장관인 감입초(외통, 외초, intussuscepien)로 구성되어 있다. 장중첩증이 진행되면서 근위부 장관과 같이 유입되어 갇힌 장간막의 혈행순환의 장애가 발생하고 장관의 부종과 허혈성 괴사 및 천공이 발생하게 된다.
초음파의 횡단면 스캔에서 부종이 심하지 않는 경우 특징적인 다층 구조(multiple concentric rings sign) 또는 과녁 징후(target sign)가 관찰되고 부종이 심해지면 층 구조가 소실되고, 저에코의 바깥층과 고에코의 중심부로 보이는 도넛 징후(doughnut sign) 또는 거짓신장 징후(pseudokidney sign)가 관찰된다. 이러한 도넛 징후는 비특이적인 소견으로 장벽비후를 일으키는 타질환에서도 보이기 때문에 부종이 심한 장관의 근위부를 스캔하여 특징적인 과녁 징후를 관찰하면 진단에 도움이 된다. 초음파의 종단면 스캔에서는 샌드위치 징후(sandwich sign)가 관찰된다.
원발성 복막수염(primary epiploic appendagitis, Fig. 22)
복막수(epiploic appendage)는 맹장부터 에스결장까지 장간막이 붙지 않는 taenia에 달려있는 작은 띠로 길이는 2-5 cm, 두께는 1-2 cm 크기로 지방과 혈관으로 구성되어 있다. 원발성 복막수염은 복막수의 염전, 허혈, 염증이 발생하여 급성 복통을 일으킨다. 주로 좌측 결장에서 많으나 우측 결장에서도 발생하고 보존적 치료로 호전된다. 초음파 소견으로는 결장에 붙어있는 압박되지 않는 고에코 원형 또는 돔형 종괴로 보이고, 장의 내강과 연결이 되지 않으며 대부분에서 얇은 저에코 테두리를 동반하고 있다[ 10]. Color Doppler 검사상에서 고에코 종괴 내에 혈류 신호는 보이지 않고 있다. 감별 진단으로는 게실염에 의한 이차성 복막수염이 있다. 게실염에서는 염증성 게실이 있는 위치에 결장이 분절성으로 비후되고 동반된 결장 주위 지방 조직 내에 점상 혈류 신호가 보인다. 복막수염에서는 결장벽에 종괴 효과는 있지만 대장벽 비후는 보이지 않고 혈류 신호도 관찰되지 않는다.
대장암(colon cancer, Fig. 23)
대장암은 발생하는 위치에 따라서 임상 증상이 차이가 나는데 우측 대장에 발생하는 경우 종괴 형성형으로써 종양에 의한 복통, 설사, 빈혈 등의 소견이 관찰되고, 좌측 대장에 발생하는 경우에는 불규칙한 대장 벽 비후와 이로 인한 협착, 혈변, 변비 및 장 폐색의 증상으로 내원하게 된다. 초음파에서 대장암은 종괴로 나타나는 경우 불규칙한 모양과 다엽상의 외연을 가진 국소적인 저에코성 병변으로 관찰되고 대장벽 비후로 나타나는 경우, 정상 대장 벽의 층 구조가 소실되고 상대적으로 짧은 분절을 침범하며 편심성의 두꺼운 벽 비후 그리고 불규칙한 외연으로 보인다[ 9]. 특히 맹장에서 발생하는 대장암의 경우 우하복부통증을 호소할 수 있는데 이는 종양 자체로 인한 통증, 종양의 천공, 종양이 충수 기저 부위를 침범하여 충수기시부 폐색이 초래되면 충수염 증상이 나타날 수도 있다. 이 경우 급성 충수염보다 증상이 길고 만성적인 특징이 있다.
요관 방광 이행부 결석(uretero-vesical junction stone, Fig. 24)
우측 하부 요로결석의 경우 우측 옆구리 통증 외에 우하복부통증을 호소할 수 있어 충수염과 감별이 필요한 질환이다. 저주파 탐촉자로써 우측 신장의 수신증 유무를 반드시 관찰해야 하고 요관방광 이행 부위에서 회색조 초음파에서 후방 음영을 동반하는 고에코의 요로결석을 확인하거나 Color Doppler 초음파에서 결석 후방으로 보이는 반짝허상(twinkle artifact)을 확인함으로써 진단할 수 있다[ 9].
난관난소농양(tubo-ovarian abscess, Fig. 25)
자궁과 난소에 발생하는 염증성 질환으로 자궁경부염, 자궁내막염, 난관염의 경과를 거쳐서 난관난소농양(tubo-ovarian abscess)이 발생한다. 경복부 초음파에 비해서 경질 초음파가 병변의 관찰에 더 정확하다. 초음파 소견은 난소의 정상 구조가 파괴되어 찾을 수 없고 여러 개의 두꺼운 벽을 가진 낭성종괴가 편측 혹은 양측에 보이는 것이 난관난소농양이다. 부인과 질환 중 충수염과 감별을 요하는 질환은 우측 난소낭종, 골반염, 난관난소농양, 자궁외임신 등이 있다[ 13]. 이 중에서 우측난관난소농양의 진단에 있어 초음파 빔의 깊은 투과가 가능한 저주파 탐촉자의 사용이 중요하다. 일반적으로 여성의 우하복부 통증의 초음파 진단에 반드시 저주파 탐촉자로 우측 난소의 병변을 확인하는 것이 중요하다.
복부 대동맥류(abdominal aortic aneurysm, Fig. 26)
복부 대동맥이 3 cm 이상으로 확장된 것으로 정의하고 60세 이상에서 5-7%의 빈도로 관찰되며 남성에서 여성에 비하여 4배 높은 빈도로 관찰된다[ 10]. 위험인자로는 남성, 60세 이상, 만성폐쇄성 폐질환, 고혈압 등이 있다. 초음파검사에서 대동맥의 직경이 3 cm 이상으로 확장되어 있고 Color Doppler 검사에서 Yin-yang sign을 관찰할 수 있다.
복직근초 혈종(rectus sheath hematoma, Fig. 27)
복직근초 혈종은 하부 복벽 혈관이 손상되어 궁상선(arcuate line) 아래의 복직근초 내에 혈종이 발생하는 매우 드문 질환이다. 항응고제를 복용하는 고령 환자나 분만한 경우, 복부수술을 받은 경우, 심한 기침이나 재채기를 하는 경우, 과도한 복벽 운동 이후, 혈액응고 질환이 있는 경우에 주로 발생하며 갑작스러운 통증을 동반한 하복부 종괴가 만져질 때 의심할 수 있다. 궁산선의 상부보다는 하부에, 좌측 복부에 비해서 우측 복부에 더 빈도가 높은 것으로 알려져 있다. 초음파 소견은 종단 스캔에서 복직근 내부에 방추형(spindle shaped), 횡단 스캔에서 난원형(oval shaped)의 병변으로 보이고 내부의 출혈 양상과 시기에 따라서 무에코 또는 비균질적인(heterogenous) 에코로 보인다[ 14].
결 론
하복부 통증을 유발하는 원인 질환은 급성 충수염과 그 외 다양한 질환이 있다. 특히 우하복부 통증 환자에서 초음파검사로써 수술이 필요한 급성 충수염을 진단함과 동시에 정상 충수를 확인함으로써 애매한 경우에 충수염을 배제할 수 있는 능력을 키우는 것이 더욱 중요하다. 또한 앞서 기술한 다양한 하복부 질환에 대한 임상적인 이해와 초음파 소견을 숙지한다면 임상 진료에 많이 활용될 수 있을 것이다.
Figure 1.
Ultrasonography of a normal bowel shows a thin anterior wall (arrows) and hyperechoic intraluminal gas which interferes with visualization of the posterior wall of the bowel. (A) Sigmoid colon. (B) Ascending colon. (C) Appendix. G, gas. 
Figure 2.
(A) Wall thickening with preserved wall layer (terminal ileitis). A longitudinal scan of the terminal ileum shows a marked wall thickening with preserved wall stratification. (B) Wall thickening without stratification (Crohn’s disease). A transverse scan of the ascending colon shows asymmetric wall thickening with a loss of wall layers. (C) Wall thickening without wall stratification (colon cancer). An ultrasonogram shows a marked wall thickening with a loss of wall layers and an ulcer. (D) Obstruction (transverse colon cancer). A longitudinal view of the ascending colon shows a markedly distended lumen (> 5 cm). (E) Increased blood flow (appendicitis). Color Doppler of a distended appendix shows increased flow signals within the appendiceal wall and mesoappendix. (F) Hyperechoic fat infiltration (appendicitis). Note the marked inflamed fat walling off the abscess. (G) Lymph node enlargement (appendicitis). Note the multiple enlarged mesenteric lymph nodes. (H) Abscess or fluid collection (perforated appendicitis). Note the hypoechoic periappendiceal fluid collection. 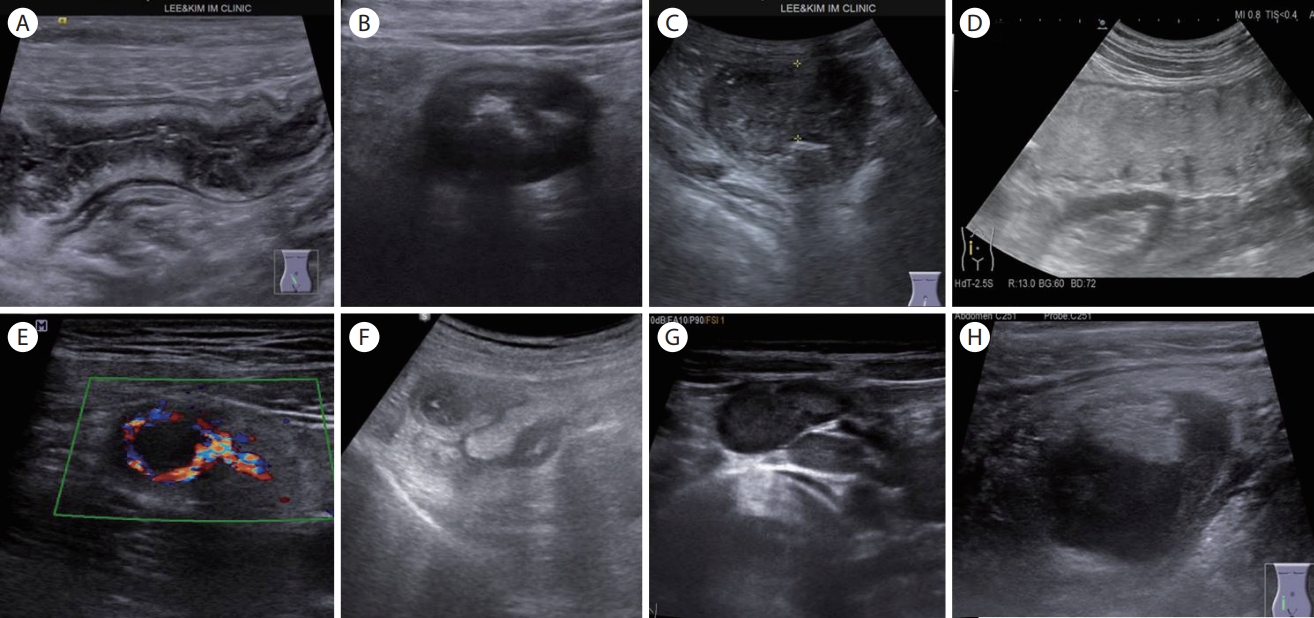
Figure 3.
(A) Before compression (diagram). (B) After compression (diagram). (C) Before compression. Note the gas filled terminal ileum (TI) which prevents clear visualization of the appendix. (D) Graded compression displaces bowel gas within the TI which allows detection of the normal appendix anterior to the psoas muscle. TI, terminal ileum; A, appendix; C, cecum; P, psoas muscle. 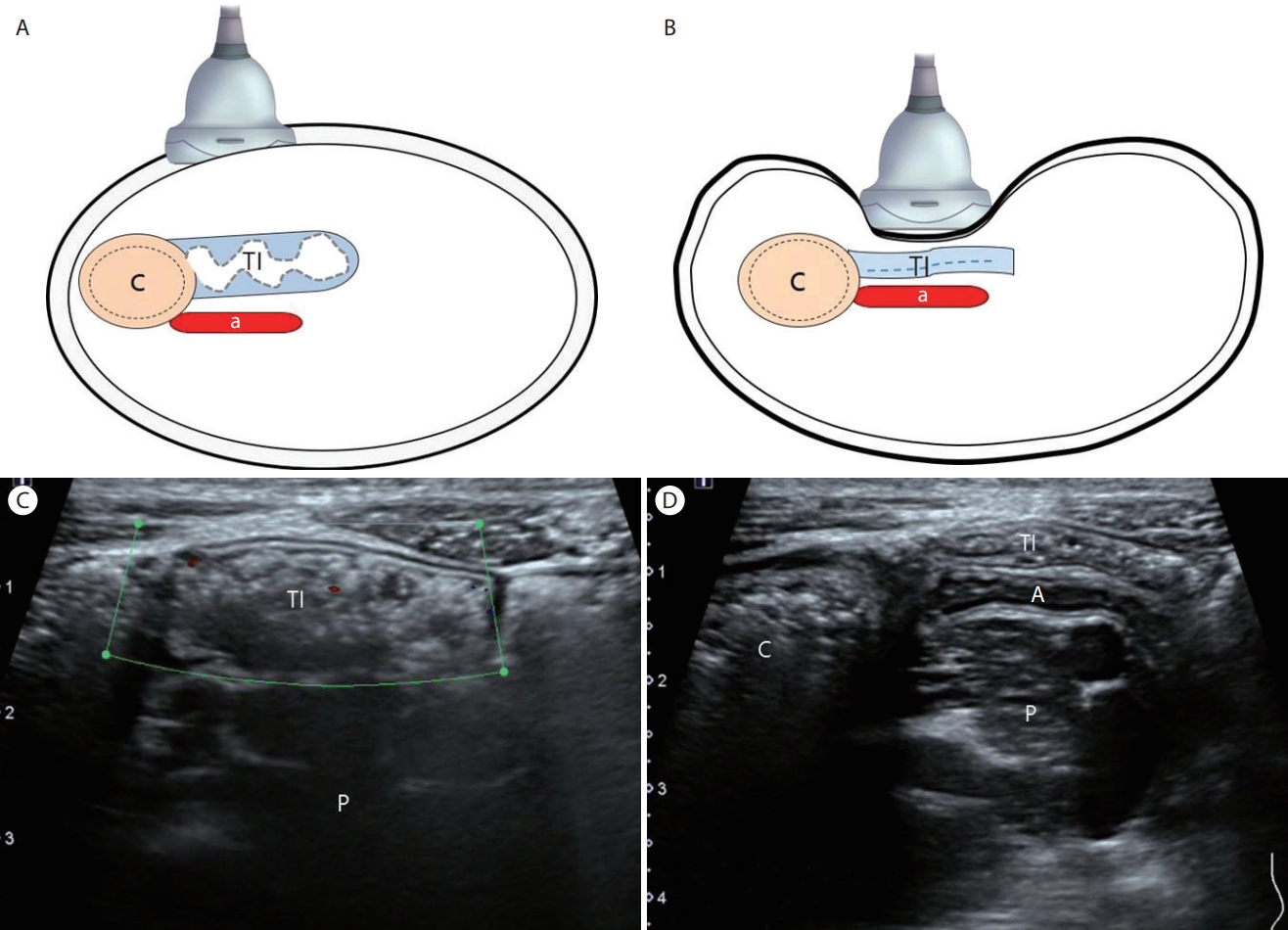
Figure 4.
Mowing the lawn. The peritoneal cavity is screened for bowel pathology by making vertical, overlapping lanes over the abdomen. Modified from the reference [ 2]. 
Figure 5.
Changing the position of the body. (A) Supine position. Note the thickened 'C' without visualization of the retrocecally positioned appendix. (B) Changing the position of the patient to left lateral decubitus while scanning the right flank allows detection of the distended appendix. Note the base 'P' of the appendix on the right side and the 'D' on the left side of the image which is reversed compared with postileal appendix. C, cecal wall; P, appendix; D, appendiceal tip; Tl, terminal ileum. 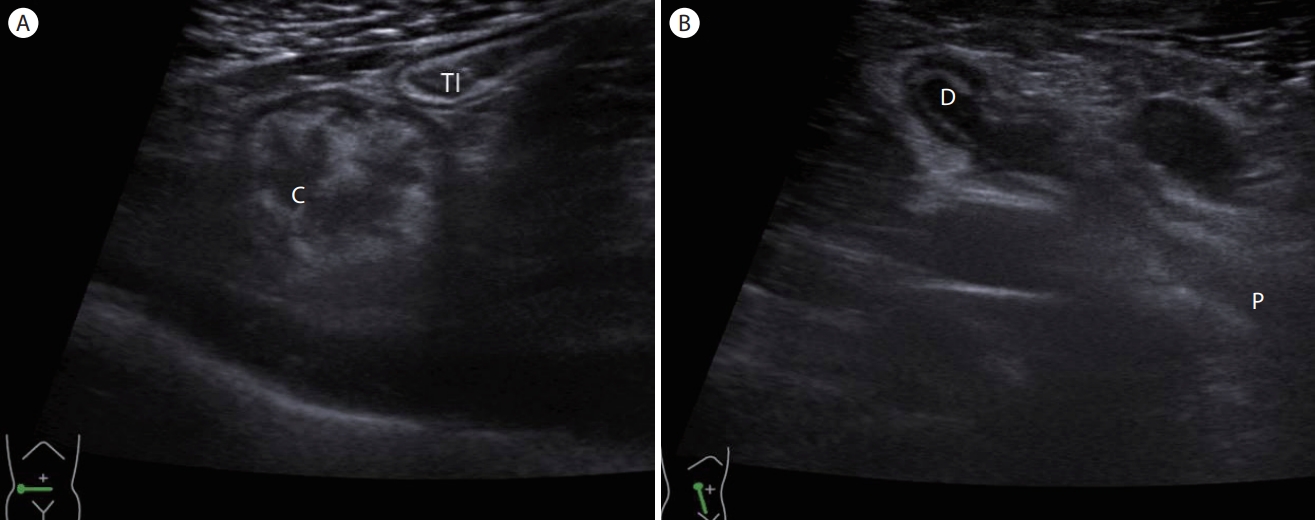
Figure 6.
(A) High frequency (9 MHz) ultrasound. Note the prominent hyperechoic fat infiltration without definite findings of appendiceal pathology. (B) Low frequency (4 MHz) ultrasound. Note the anechoic fluid collection (arrow) within the pelvic cavity which was not detected with a high frequency transducer. TI, terminal ileum; F, fat infiltration. 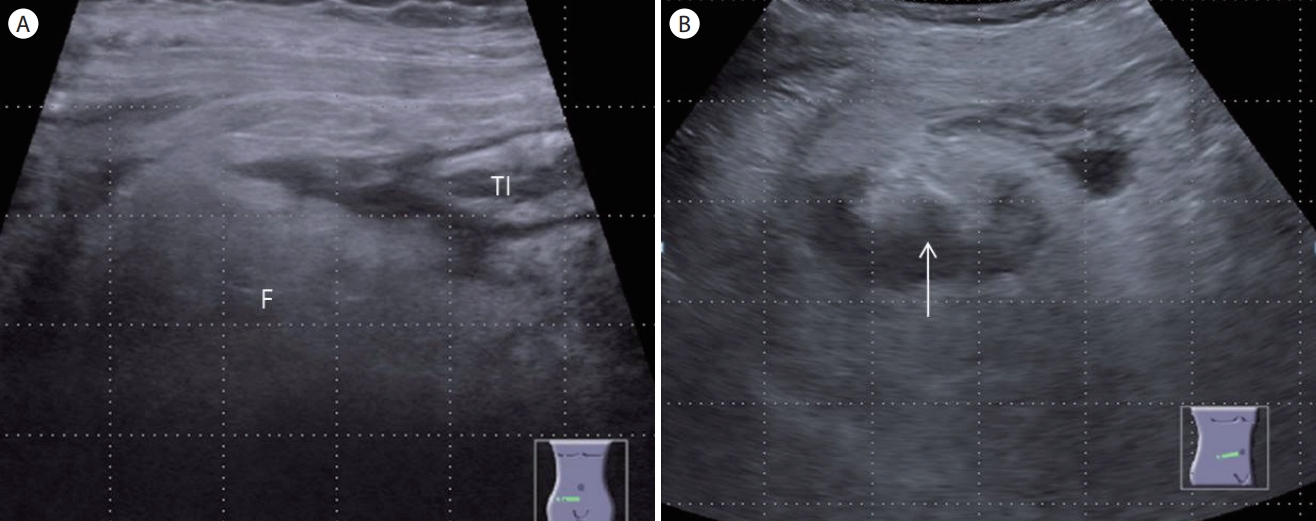
Figure 7.
Ultrasonographic findings of appendicitis. (A) Increased maximal outer diameter of appendix > 6 mm. (B) Increased maximal mural thickness > 3 mm. (C) Noncompressible appendix. (D) Appendicolith. (E) Periappendiceal fat infiltration. (F) Increased vascularity within appendiceal wall (long arrow) and mesoappendix (short arrow). (G) Fluid collection or abscess. (H) Mesenteric lymph node enlargement. (I) Cecal wall thickening. A, appendix; F, fat infilitration. 
Figure 8.
(A) Suppurative appendicitis. A longitudinal section of the appendicitis shows a distended tubular structure with thickening of the echogenic submucosal layer (arrow). (B) A transverse section shows a noncompressible, round, and inflamed appendix with periappendiceal fatty change. A, appendicitis; F, fat infiltration. 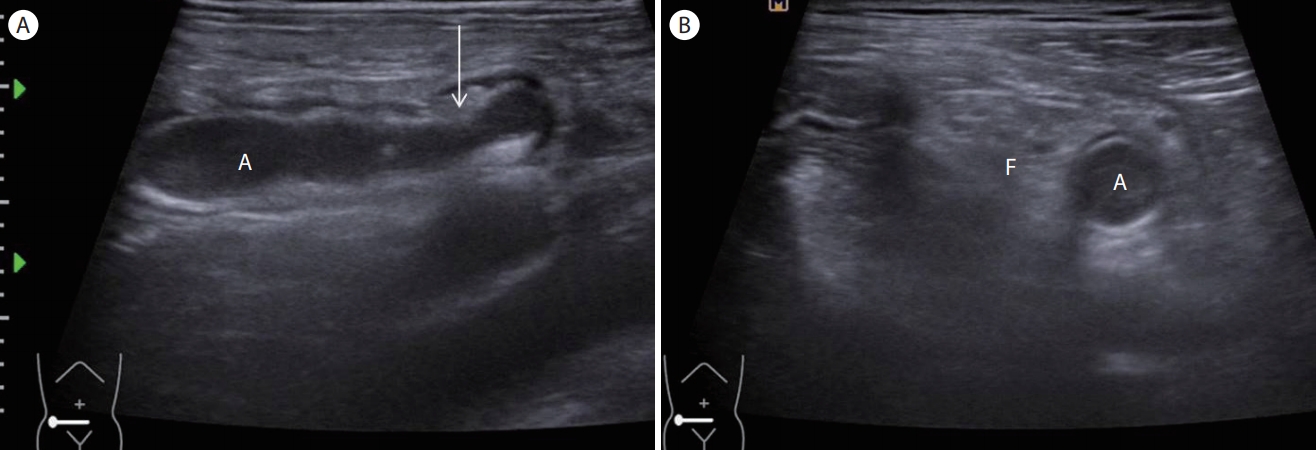
Figure 9.
Gangrenous appendicitis. (A) A transverse section demonstrates a round distended appendix 'A' with some loss of submucosal layer indicating gangrenous change within the 'A'. (B) A color Doppler transverse section of the 'A' shows an absence of the vascularity indicating gangrenous change. 
Figure 10.
A longitudinal section of the appendix shows a normal proximal appendix (arrowheads) draping over the iliac vessel and the distended tip of the appendix. Note the two hyperechoic appendicoliths (arrows) with posterior acoustic shadowing. C, cecum; P, psoas muscle; IV, iliac vessel; T, tip of appendix. 
Figure 11.
(A) Retrocecal appendix. (B) Note the base of the appendix (short arrow) on the right side and the appendiceal tip (long arrow) on the left side of the image which is reversed compared with the postileal appendix. App, appendix. 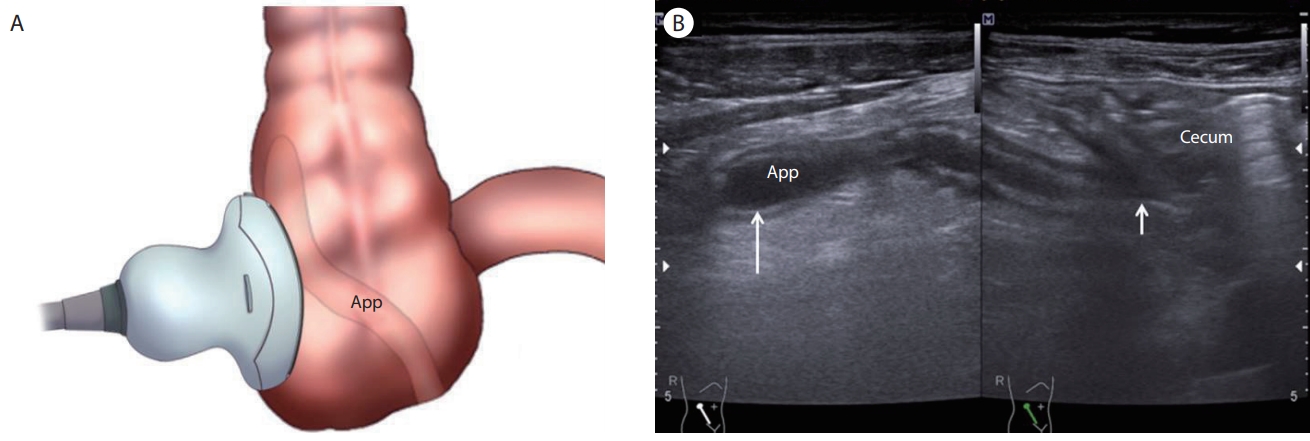
Figure 12.
Perforated appendicitis. (A) A longitudinal section of the distal appendix shows some loss of the submucosa on the posterior wall of the appendix (arrows). (B) A transverse section of the appendix shows periappendiceal fluid collection (arrow). (C) Note the normal-appearing proximal appendix (arrow) with a periappendiceal abscess. A, abscess. 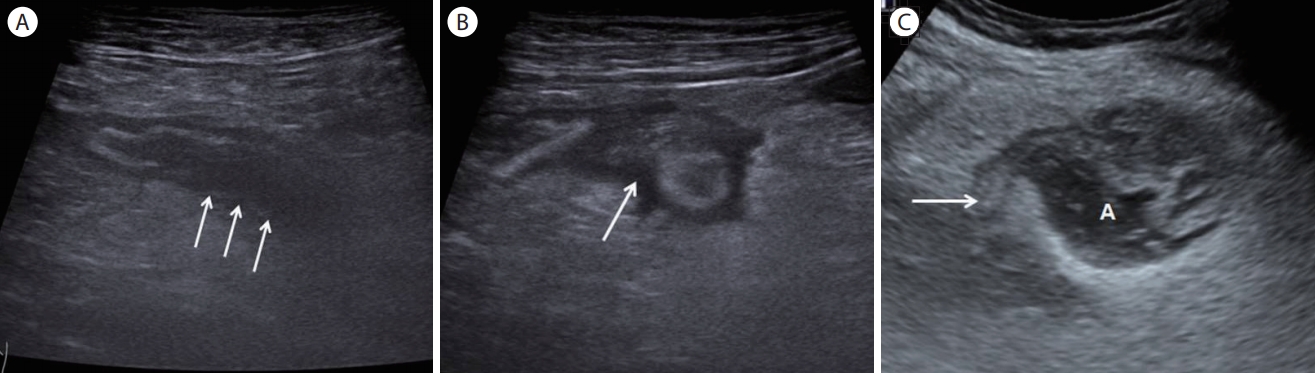
Figure 13.
Appendiceal mucocele. (A) A transverse scan of the right iliac fossa shows an approximately 1.76 cm round cystic mass. (B) A longitudinal section of the cystic mass shows a typical “onion skin sign” indicating appendiceal mucocele. (C) A computed tomography coronal section shows an oval shaped hypodense mass (arrow) in the subcecal area. M, mass. 
Figure 14.
Appendiceal cancer. A longitudinal section of the appendix shows an intraluminal hypoechoic mass ('M') with irregular margins which disrupts the appendiceal wall indicating malignant tumor. Note mildly distended lumen distal to appendiceal 'M'. 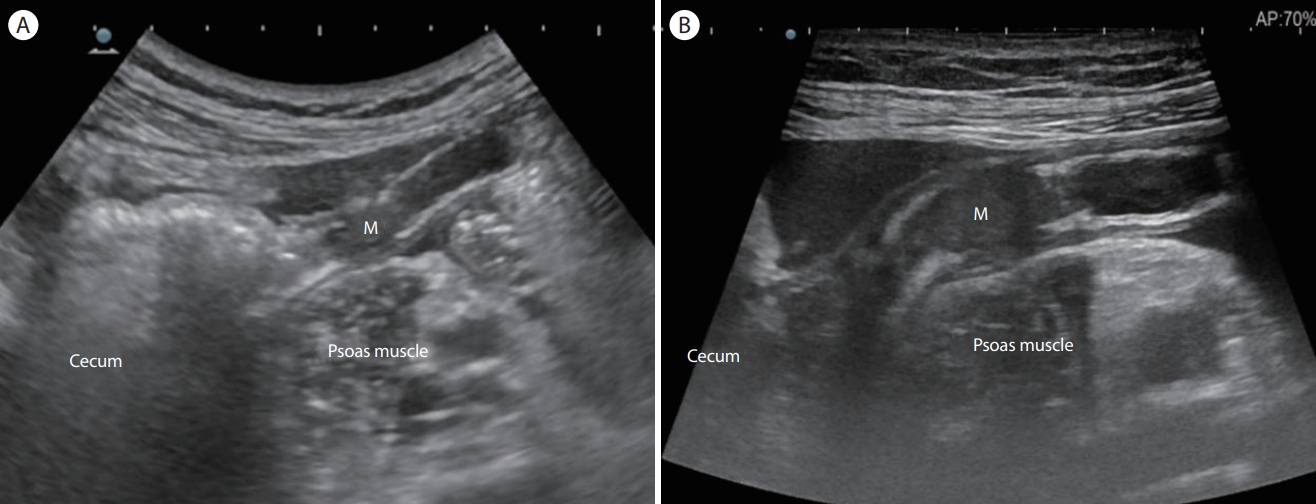
Figure 15.
Cecal diverticulitis. (A) An ultrasonogram shows an echo-poor protrusion 'D' from the colonic wall indicating an inflamed colonic diverticulum surrounded by hyperechoic noncompressible fat (long arrow). Note an echogenic fecalith within the diverticular sac (short arrow) and peridiverticular colonic wall thickening (thick arrow). (B) A Color Doppler ultrasound shows hyperemia within the inflamed diverticular wall (arrow) and peridiverticular area. 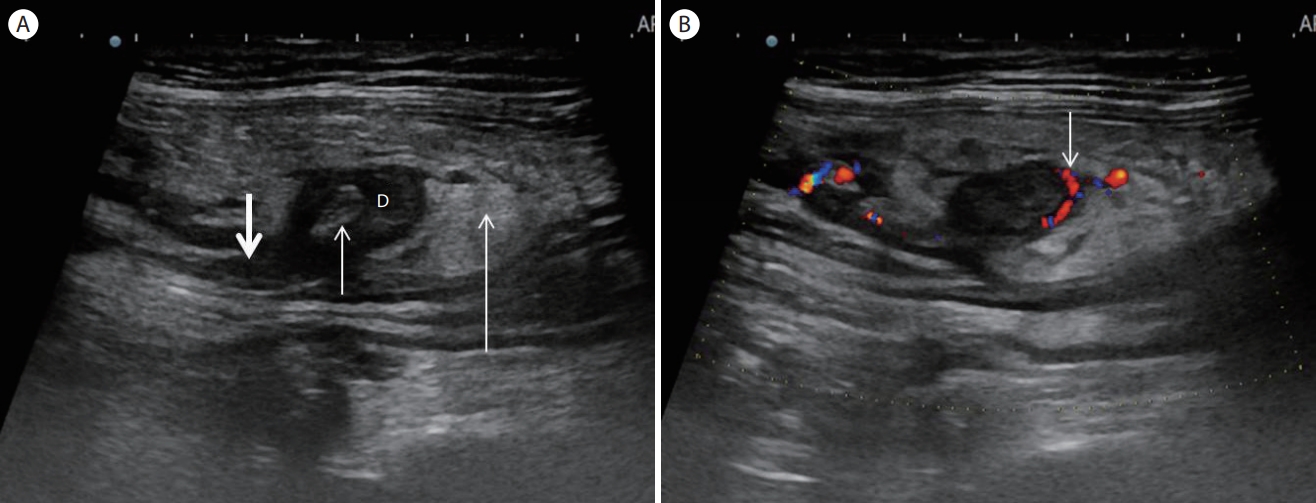
Figure 16.
Infectious ileocecitis. (A) A transverse scan of the right iliac fossa shows a marked wall thickening of the ileocecal valve (arrows). (B) A longitudinal scan of the ascending colon shows prominent colon wall thickening with preserved wall stratification (arrows). (C) An ultrasound of the right iliac fossa shows multiple lymph node enlargement. TI, terminal ileum. 
Figure 17.
Ischemic colitis. (A) A transverse section of the sigmoid colon shows prominent wall thickening (arrows). Note the thickening of mucosa, submucosa and muscularis propria with a partial loss of wall stratification. (B) A longitudinal section of the sigmoid colon reveals wall thickening. Note the loss of vascularity within the thickened sigmoid colon. (C) A colonoscopy shows multiple deep longitudinal ulcers with bleeding, with intervening normal mucosa. 
Figure 18.
Crohn’s disease. (A) A transverse section of the ascending colon shows irregular wall thickening with a partial loss of wall layers. Note the echogenic spots within the thickened wall indicating ulceration (arrow). (B) A colonoscopy shows a longitudinal ulceration with a typical cobblestone appearance. 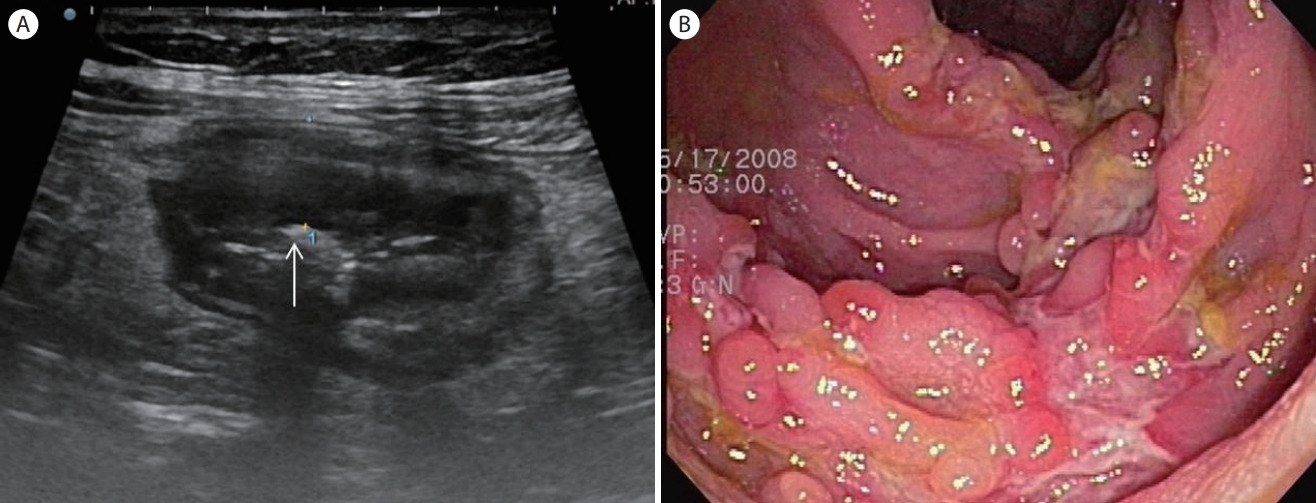
Figure 19.
Ulcerative colitis, mild form. (A, B) Transverse and longitudinal sections of the sigmoid colon show bowel wall thickening which mainly consists of submucosa with well-preserved wall layers. (C) A colonoscopy shows multiple shallow ulcerations and mucosal hyperemia. SM, submucosa. 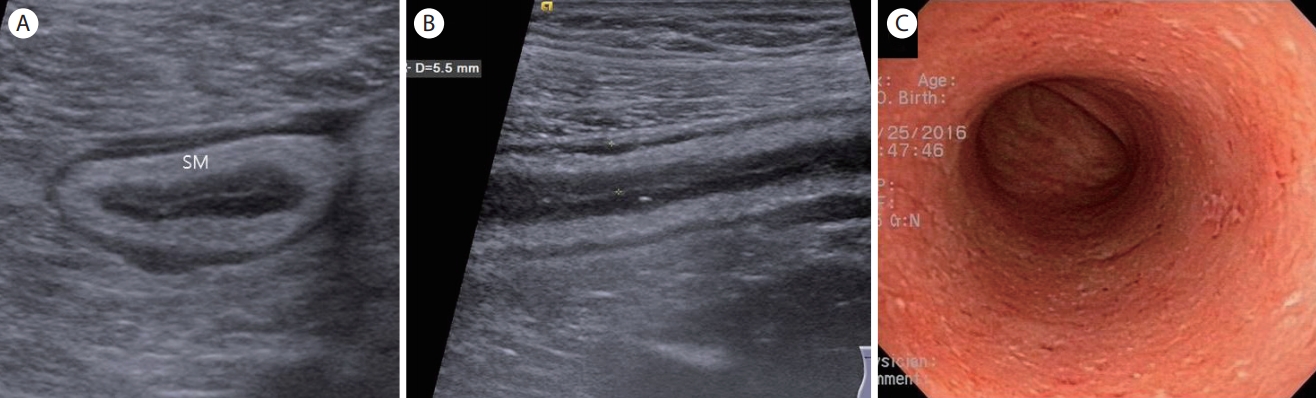
Figure 20.
Ulcerative colitis, severe form. (A) Low frequency ultrasound shows a markedly thickened sigmoid colon with a loss of wall layers. (B) Color Doppler ultrasound shows mildly increased vascularity. (C) A colonoscopy shows mucosal edema, hyperemia, ulceration, and bleeding. 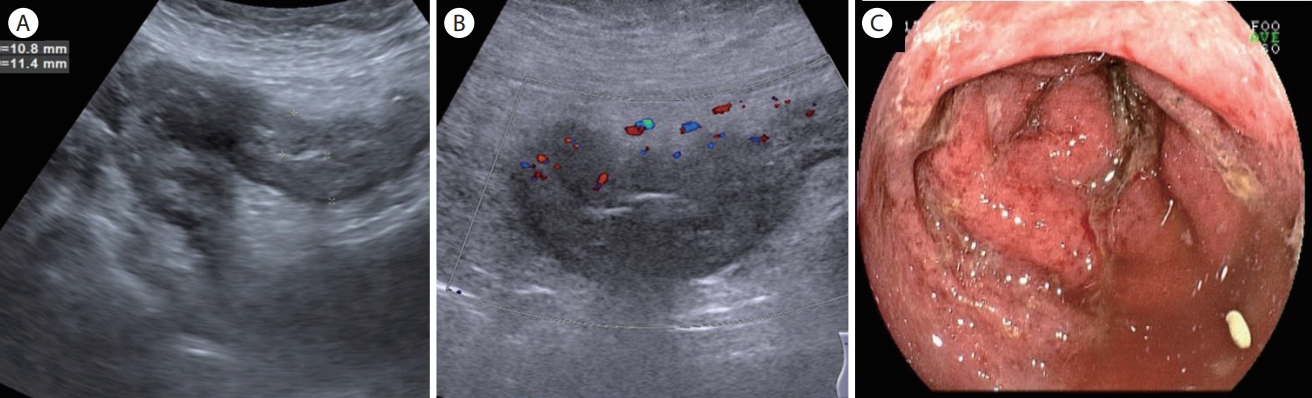
Figure 21.
Intussusception. (A) A transverse section of the bowel shows multiple concentric ring sign which consists of the intussusceptum (long arrow) and the intussuscepien (short arrow). Note the multiple lymph nodes within the intussusceptum. (B) A longitudinal section of the bowel shows a “sandwich sign”. P, proximal bowel; D, distal bowel; LN, lymph nodes. 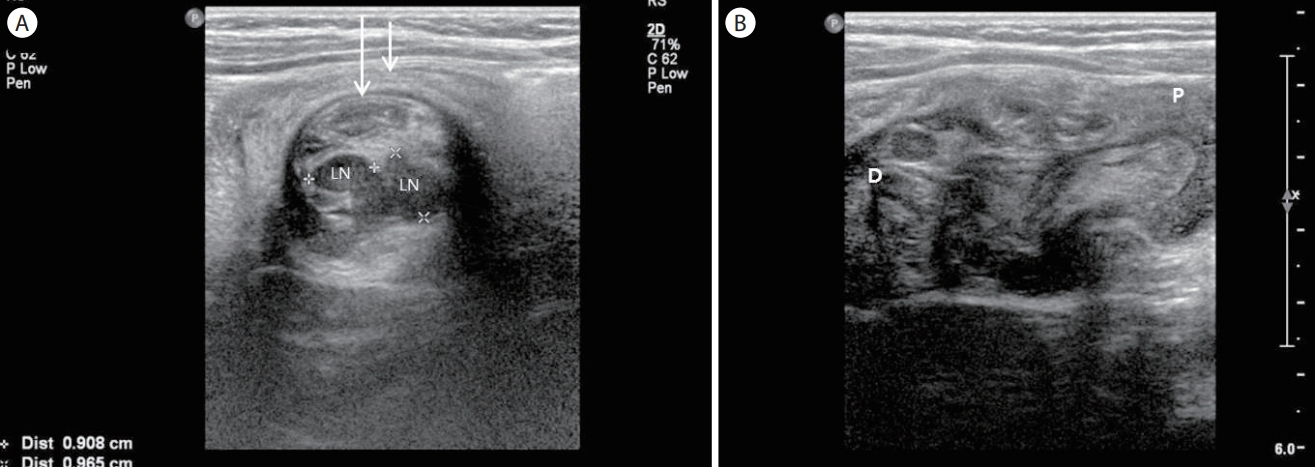
Figure 22.
Epiploic appendagitis. (A) Ultrasonography demonstrates a round epiploic appendagitis with a hypoechoic halo (arrow) which does not communicate with colonic lumen. (B) Ultrasonography shows an oval shaped echogenic mass with a central anechoic spot which is located outside of the colonic wall. Note the hypoechoic halo (arrow) indicating a thickened visceral peritoneum. EA, epiploic appendagitis. 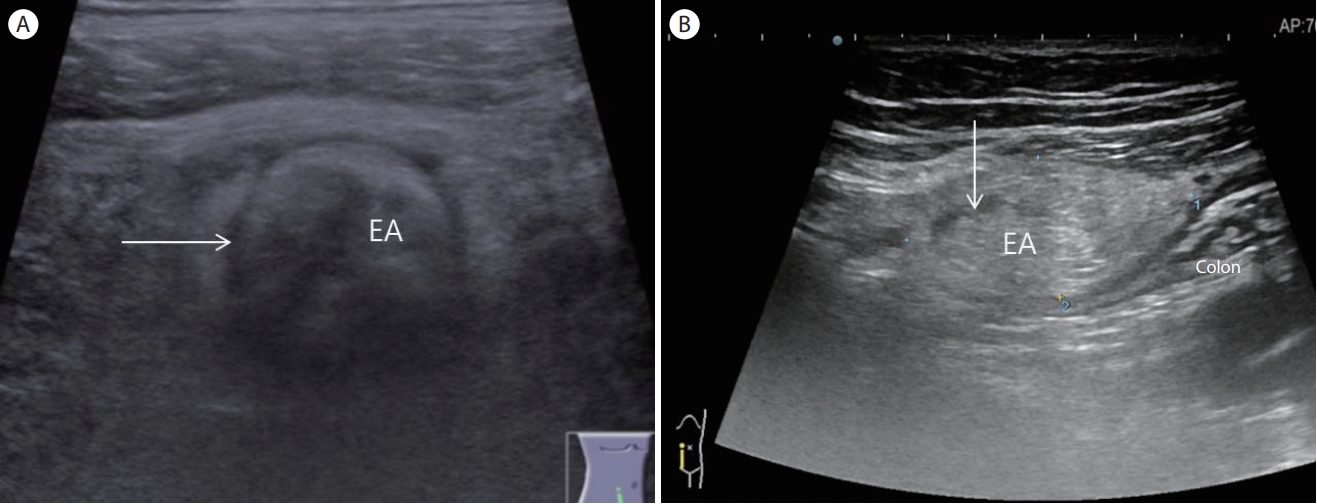
Figure 23.
Colon cancer. (A) A transverse section of the ascending colon shows a hypoechoic mass with irregular margins and loss of wall stratification. Note the centrally located echogenic spots within the thickened hypoechoic colonic wall (pseudokidney sign). (B) Colonoscopy reveals an ulcerating mass with easy contact bleeding in the ascending colon. (C) An ultrasonogram shows asymmetric colon wall thickening with a loss of wall stratification. Note the echogenic foci (arrow) indicating ulceration within the tumor mass 'M'. (D) Colonoscopy reveals encircling mass 'M' with luminal narrowing in the sigmoid colon. 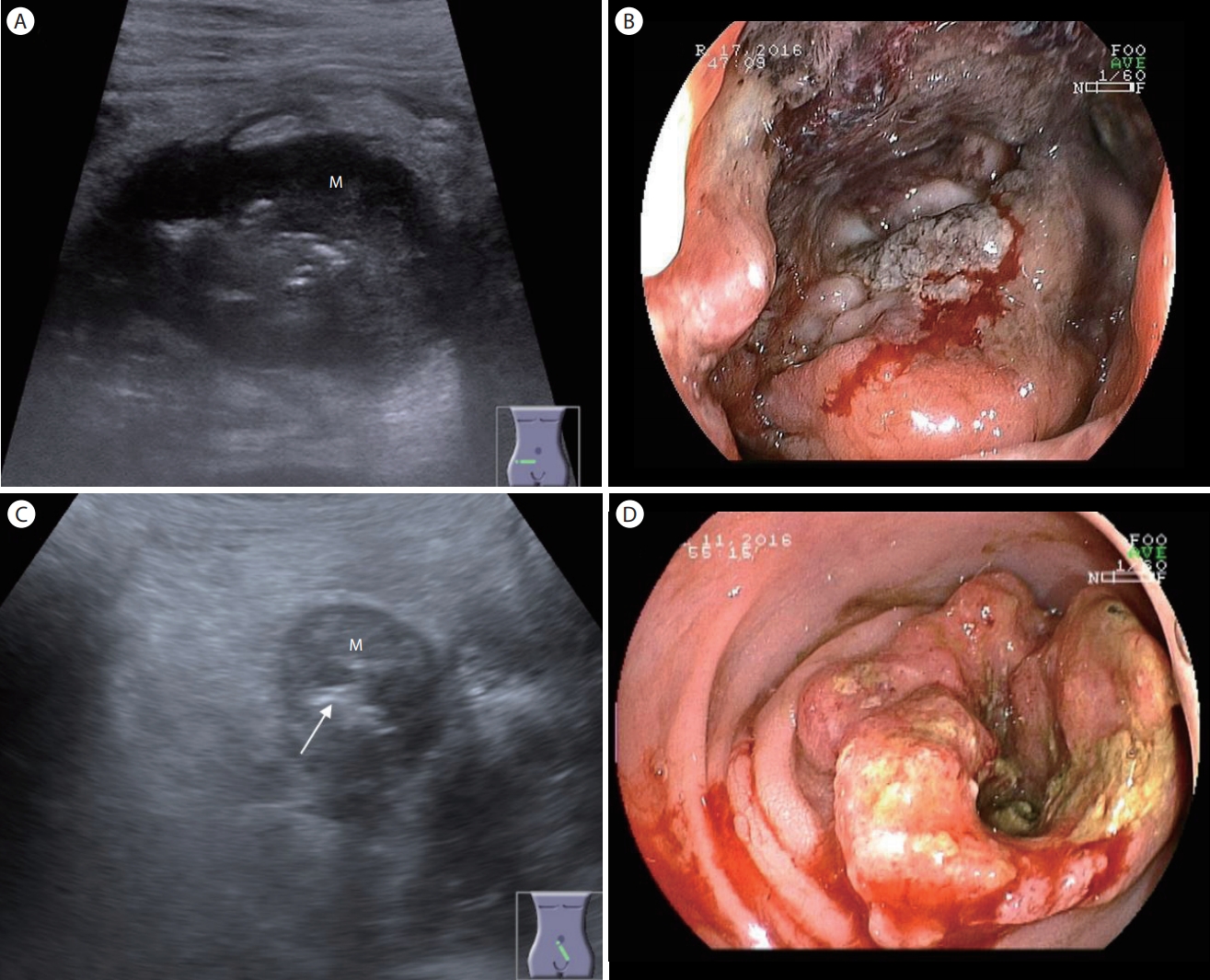
Figure 24.
Ureterovesical junction stone. (A) An ultrasonogram demonstrates an echogenic stone (arrow) with posterior acoustic shadowing at the left ureterovesical junction. (B) Color Doppler shows a twinkle artifact (arrow) posterior to the ureterovesical stone. UVJ, ureterovesical junction; UB, urinary bladder. 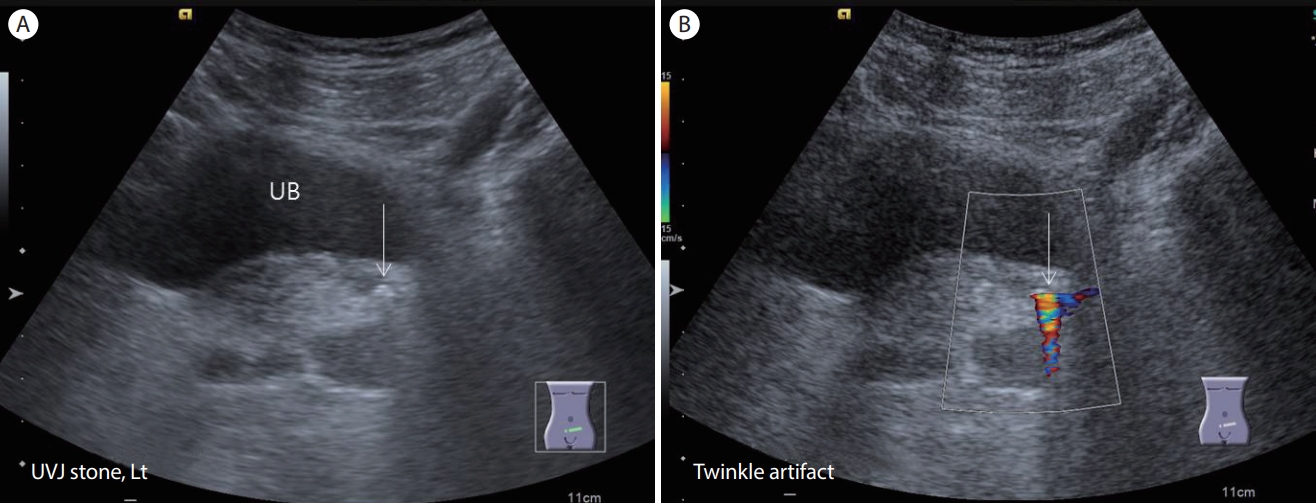
Figure 25.
Tubo-ovarian abscess. An ultrasonogram shows an approximately 5 × 7 cm multiloculated cystic lesion with thick septations at right lower abdomen. 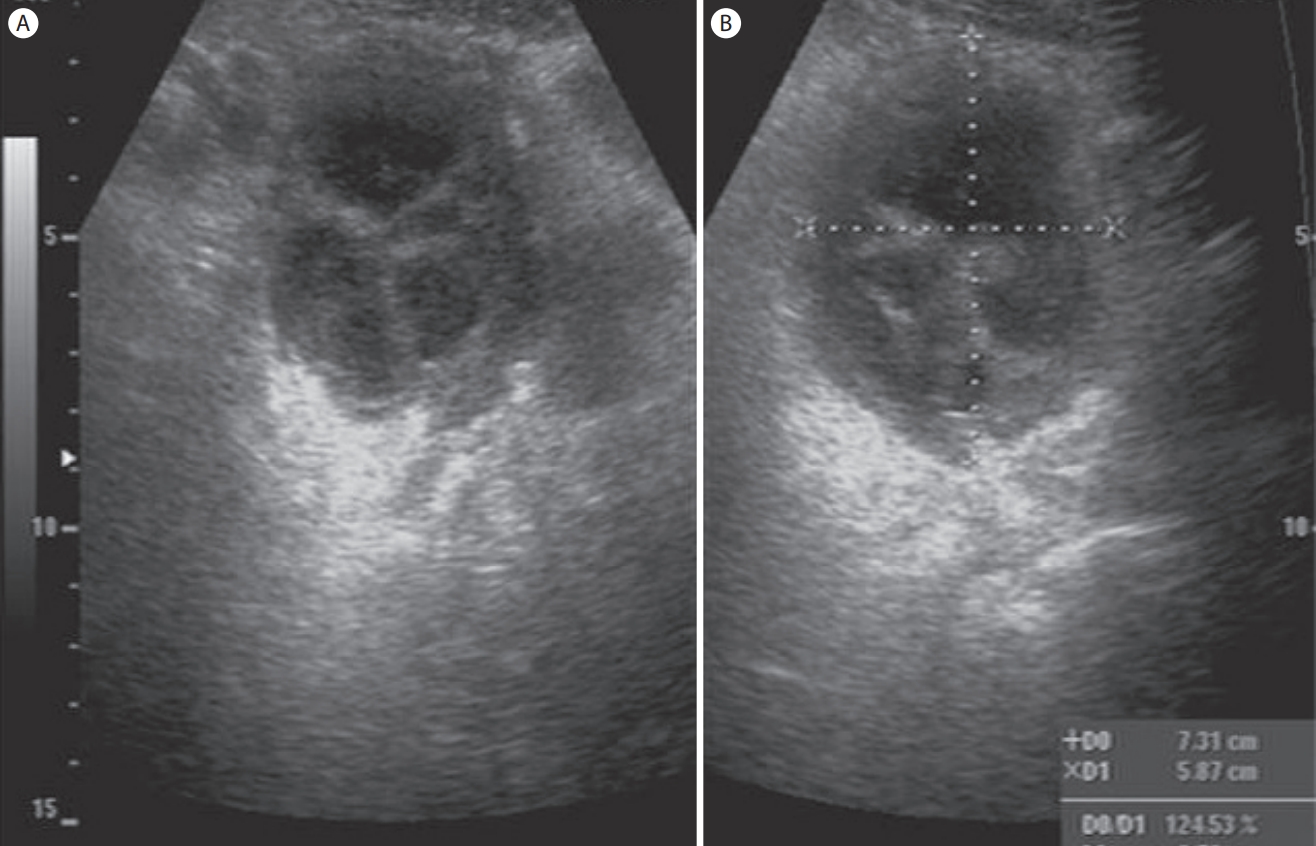
Figure 26.
Abdominal aortic aneurysm. (A) An ultrasonogram shows an approximately 5 cm pulsating round cystic lesion in the periumbilical area. (B) Color Doppler shows bidirectional flows due to the swirling of blood within the abdominal aortic aneurysm (Yin-yang sign). Ao, aorta. 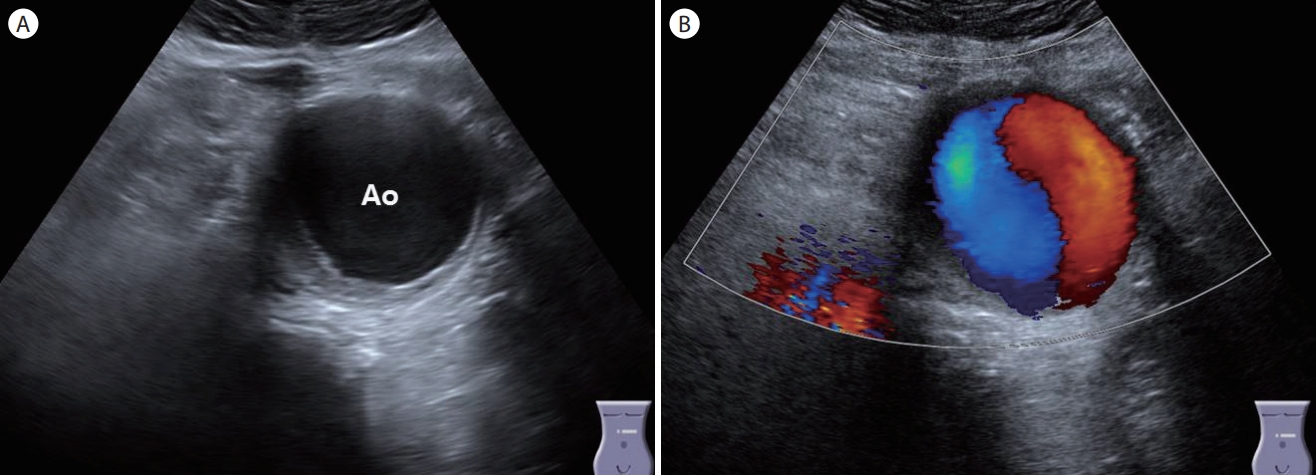
Figure 27.
Rectus sheath hematoma. (A) A longitudinal scan of the lower abdomen shows a spindle-shaped anechoic lesion (arrow) within the rectus abdominis muscle 'R' in a patient with lower abdominal pain after strenuous exercise. (B) A transverse scan of the lower abdomen demonstrates an oval-shaped anechoic lesion (arrow) within the rectus abdominis muscle. R, rectus abdominis muscle. 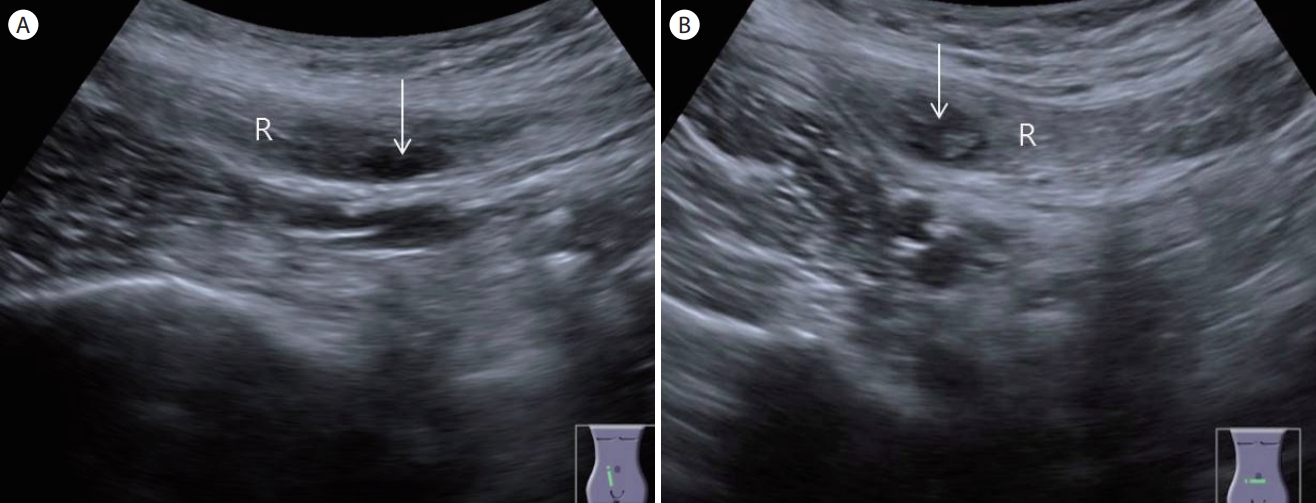
Table 1.
Causes of lower abdominal pain
|
Category |
Characteristic diseases |
|
Gastrointestinal |
Appendicitis, diverticulitis, colon cancer, infectious colitis, lymphoma, Crohn's disease, tuberculosis, intussusception |
|
Pericolic |
Epiploic appendagitis, omental infarction, mesenteric lymphadenitis |
|
Urologic |
Ureterovesical stone |
|
Gynecologic |
Pelvic inflammatory disease, tubo-ovarian abscess, ovarian cyst rupture, ovarian tumor, hemorrhagic ovarian cyst, ectopic pregnancy, pelvic congestion syndrome |
|
Others |
Rectus sheath hematoma, aortic aneurysm |
REFERENCES
1. Puylaert JB. Acute appendicitis: US evaluation using graded compression. Radiology 1986;158:355–360.   2. Mallin M, Dawson M. Introduction to bedside ultrasound. 2nd ed. Lexington: Emergency Ultrasound Solutions,, 2013.
3. Jeffrey RB Jr, Laing FC, Lewis FR. Acute appendicitis: high-resolution real-time US findings. Radiology 1987;163:11–14.   4. Jeffrey RB Jr, Laing FC, Townsend RR. Acute appendicitis: sonographic criteria based on 250 cases. Radiology 1988;167:327–329.   5. Kim DH. Ultrasonography of appendicitis. Clin Ultrasound 2016;1:19–38.   6. Sivit CJ. Diagnosis of acute appendicitis in children: spectrum of sonographic findings. AJR Am J Roentgenol 1993;161:147–152.   7. Sivit CJ, Siegel MJ, Applegate KE, Newman KD. When appendicitis is suspected in children. Radiographics 2001;21:247–262. questionnaire 288-294.   8. Lim HK, Lee WJ, Lee SJ, Namgung S, Lim JH. Focal appendicitis confined to the tip: diagnosis at US. Radiology 1996;200:799–801.   9. Kim DH. Ultrasound of the digestive tract with case review. Seoul: Pan Mun Education,, 2018.
10. Choi BI. Ultrasound diagnosis of the abdomen. 3rd ed. Seoul: Iljogak, 2015.
11. Higa E, Rosai J, Pizzimbono C, Wise L. Mucosal hyperplasia, mucinous cystadenoma of the appendix. A re-evaluation of appendiceal mucocele. Cancer 1973;32:1525–1541.   12. Chang P, Attiyeh FF. Adenocarcinoma of the appendix. Dis Colon Rectum 1981;24:176–180.   13. Brown DL, Dudiak KM, Laing FC. Adnexal masses: US characterization and reporting. Radiology 2010;254:342–354.   14. Lewiss RE, Wu S. Ultrasound diagnosis of rectus sheath hematoma. J Emerg Med 2012;4:e337–e338. 
|
|






































