서 론
췌관내 유두상 점액성종양(intraductal papillary mucinous neoplasm, IPMN)은 증식성 종양에서 침윤성 암에 이르기까지 다양한 단계를 보인다[1]. IPMN은 진단과 치료에 있어 문제는 수술 전 악성으로 변화 정도 및 췌관 침범 여부의 평가의 어려움에서 기인한다[2,3]. IPMN은 샘암종 연쇄 결과로 이어질 수 있기 때문에 종양의 수술적 절제가 치료로 권장된다[2]. IPMN의 수술적 절제술 목적은 전암성 병변을 수술로 미리 절제하고, 악성 형질전환을 예방하며, 췌장 점액으로 야기될 수 있는 반복적인 증상이 생기는 것을 예방하는 것이다. IPMN 환자에서 잠재적 악성 병변을 포함하고, 내분비 및 외분비 기능을 보존할 수 있는 충분한 췌장 조직을 남겨놓는 췌장 부분절제술은 IPMN의 병변 범위를 진단할 수 있는 신뢰도가 높은 수술 전 검사를 필요로 한다. 그러므로 IPMN 환자에서 췌장 완치절제술을 시행하고자 하는 외과 의사에게 췌장절제술의 적절한 범위를 결정하는 것은 많은 주의가 필요하다. 컴퓨터단층촬영(computed tomography, CT), 자기공명영상(magnetic resonance imaging, MRI) 또는 수술 중 육안 거시적 검사 같은 수술 전 영상검사는 종양의 관내 침윤 정도를 예측할 때 많은 한계점이 존재한다[4].
대상 및 방법
대상
1988년 1월부터 2008년 10월까지 수술 후 병리학적으로 확인된 40명의 환자(남자 20명, 여자 20명, 평균 연령 59세, 범위 35-81세)를 대상으로 하였다. CT/MRI, 내시경초음파(endoscopic ultrasound, EUS) 또는 역행성 내시경 췌장검사(endoscopic retrograde pancreatography, ERP)에서 주췌관 근위부에서 관내 고정된 혹은 무정형의 충만결손이 보이지 않는 미만성 또는 국소적인 주췌관 확장이 보이거나, 주췌관과 교통하는 낭내 결손을 갖는 단방 혹은 다발성 낭종이 관찰되면 IPMN으로 진단하였다. 환자군은 IPMN의 하위 유형을 나눈 후 컴퓨터를 이용하여 IDUS로 검사할 군과 다른 영상검사로 검사할 대조군으로 분류하였다.
IPMN은 종양의 위치에 따라 3가지로 하위 분류하였다. 주췌관형 IPMN은 주췌관의 미만성 확장이, 분지췌관형 IPMN은 분지췌관의 낭성 확장 소견이 특정적이다. 혼합형 IPMN (n = 8)은 주췌관과 분지췌관 확장이 모두 관찰된다. 본 저널은 전향적 연구로 순천향대학교 윤리위원회의 승인을 받았으며, 모든 환자는 시술 전에 사전 서면동의서를 받았다.
수술 전 검사
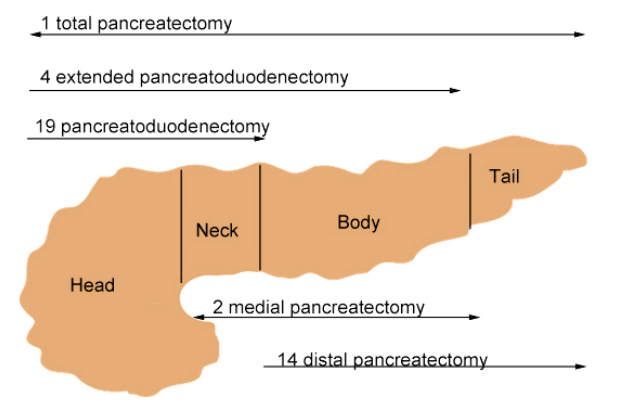
수술 전 모든 환자는 복부 CT (n = 40), 자기공명 담도조영술(magnetic resonance cholangiopancreatography [MRCP]; n = 32), 초음파내시경(EUS; n = 30), 내시경 역행 췌담관 조영술(endoscopic retrograde cholangiopancreatography [ERCP]; n = 40)을 이용하여 평가를 받았다. 위의 언급된 검사로 병변을 평가한 후 환자는 IDUS로 검사를 진행할 군과 그렇지 않을 군으로 무작위 분류하였다. 외과적 수술적 절제의 적응증은 다음과 같다. 주췌관형 IPMN, 내벽 결절 또는 유상 돌기가 관찰될 때, 병변 크기가 3 cm 이상으로 측정될 때이다. 수술 전 IDUS 검사를 통해 췌장의 4개의 분획(두부를 포함한 구상돌기, 목, 체부 그리고 미부(Fig. 1) 구분과 주췌관 및 분지췌관의 침범 여부에 대해 자세한 정보를 얻을 수 있었다. 형광 투시경(fluoroscopy)은 췌관 조영을 통해 상대적인 IDUS 탐침 위치에 대한 정보를 제공하였다. 수술 전 IDUS 소견과 수술 후 얻은 IPMN의 병리학적 동결절편검사 결과와 비교하였다.
IDUS는 20명의 환자 중 2명의 환자에서 시행할 수 없었는데 그 이유는 췌관내 심한 굴곡으로 인해 탐침이 췌관의 경부 부분을 통과할 수 없었기 때문이었다.
내시경역행췌관조영술(ERP)과 관강내 초음파검사(IDUS)
내시경역행췌관조영술(ERP)은 표준 십이지장경검사(JF 230 or 240; Olympus, Tokyo, Japan)를 사용하여 검사하였다. 췌관 삽입 후, 조영제를 주입하여 조영된 췌관을 관찰하였다. IPMN은 주췌관이 점액으로 채워진 경우에는 풍선 카테터를 가능한 췌장 미부까지 삽입하여 점액을 십이지장으로 배출시켜 종양의 범위를 측정하였다. 중합체로 코팅된 가이드와이어를 먼저 췌관 미부까지 삽입시킨 후, 2.0 mm 직경을 갖는 20 MHz (UM-G20-29R; Olympus) 초음파 탐침을 가이드와이어를 따라서 삽입 후 검사를 진행하였다. IDUS는 0.1 mm 축 해상도를 가지며, 최대 20 mm까지 침투 가능하여 실시간으로 고해상도의 단면영상을 제공한다. 탐침의 끝 부분에는 가이드와이어를 위한 얇은 슬릿이 존재하여 내시경 괄약근절개술 없이 십이지장 주 유두를 통과 가능하였다. 탐침은 가이드와이어를 따라 십이지장경내시경의 겸자 채널을 통해 십이지장 주 유두의 입구를 통과하여 췌관 미부까지 삽입시킨 후 탐침을 미부에서 유두부까지 이동시키면서 췌관 안의 구조를 검사하였다.
관강내 초음파검사(IDUS)의 해석
IDUS의 영상은 전향적으로 췌담관의 병변에 대해 복부 초음파 및 췌담관 조영술 외 다른 정보 없이 평균 1년에 500예의 ERCP 및 80예 이상의 IDUS를 시행한 두 명의 전문가(C. Y. K. and C. Y. D.)에 의해 검토되었다. IDUS를 통해 관찰된 주췌관의 돌출 부분과 분지췌관의 낭종 확장 소견은 종양으로 간주하였다. IDUS로 검사하는 동안, 췌관에서 종양의 범위를 확인하기 위해 연속 촬영된 X-ray 영상을 이용하였다. 이러한 IDUS 결과를 바탕으로, 외과 의사는 종양절제를 위한 범위 및 라인을 판단하여 췌장절제술에 적용하였다.
수술 과정
수술 전 검사 결과를 기반으로 예측된 IPMN 범위를 기반으로, 다양한 형태의 제한된 췌장절제술을 계획하였다. 수술의 목적은 확인된 IPMN의 병변을 전 절제하고 내분비 및 외분비기능이 보존되도록 충분한 잔여 췌장조직을 남기는 것으로 계획하였다(Fig. 1). 표준 췌십이지장절제술(standard pancreaticoduodenectomy)은 병변이 간문맥 축의 오른쪽에 위치할 경우, 광범위 췌십이지장절제술(extended pancreaticoduodenectomy)의 경우는 병변이 두부부터 체부까지 위치하였을 때 시행하였다. 중앙 췌십이지장절제술(medial pancreaticoduodenectomy)은 병변이 경부에 위치할 경우, 원위 췌십이지장절제술(distal pancreaticoduodenectomy)은 병변이 췌부부터 미부까지 위치할 경우 적용하였다. 총 췌십이지장절제술(total pancreaticoduodenectomy)은 전 췌장에 걸쳐 병변이 예상되는 경우 시행하였다. IPMN 환자에서 췌장절제술은 수술 전 영상검사를 기반으로 내분비 및 외분비 췌장기능을 담당하는 췌장 실질을 보존하는 방향으로 계획하였다. IDUS에 의해 평가된 췌장 병변과 수술 중 얻은 동결절편검사와 비교하였다. 수술 중 얻은 동결절편검사에서 침윤성 암이나 제자리 암이 경계에 존재할 경우 추가 췌장절제술을 시행하였다. 췌장 절제면에서 비침윤성 IPMN의 경우 환자의 나이와 예상되는 합병증을 평가하여 각각 개별화하여 관리하였다. 총 췌장절제술의 경우 IDUS에서 미만성 병변이 전 췌장에 퍼져있는 경우 혹은 췌장 절제면에서 침윤성 IPMN이 양성 경계를 보일 경우 시행하였다.
병리
수술 후 얻은 췌장 표본은 주췌관과 확장된 분지췌관을 따라 절개 후 10% 포름알데히드용액에 보관하였다. 외과 수술 후 표시된 가이드 스티치를 따라 췌장을 4부분(head, neck, body, and tail; Fig. 1)으로 나누었고 이를 기준으로 IPMN의 범위를 평가하였다. 주췌관과 분지췌관의 침범 여부 및 절제된 췌장 절단면의 조직학적 상태를 평가하였다. 상피 이형성 정도는 WHO 기준[7]에 따라 4가지 adenoma (n = 6), borderline (n = 13), carcinoma in situ (CIS; n = 6), invasive carcinoma (n = 15)로 분류하였다. 한 병변에 다양한 상피 이형성이 존재할 경우 가장 안 좋은 형태로 평가하였다. 절제된 경계의 경우 음성(normal columnar epithelium or denuded)과 양성(dysplasia or carcinoma)으로 분류하여 평가하였다[8].
결 과
환자군과 대조군의 환자 특성 및 임상적 세부사항은 유사하였다(Table 1). 40명의 IPMN 환자에서 임상 증상은 35명(80%)에서 보였고, 각각 복부 통증(n = 11), 체중감소(n = 8), 만져지는 종괴(n = 2), 급성 췌장염(n = 8) 그리고 황달(n = 6)이었다. 임상 증상이 없는 8명의 환자는 검진 복부 초음파에서 낭성 병변이나 확장된 췌관 결과를 보인 본원이나 타 병원에서 진단받아 의뢰된 환자였다. 당뇨병 환자는 12명(30%)이었고, 급성 췌장염은 8명(20%)이었다. 증상 및 징후가 있었던 환자에서 비침윤성 IPMN(40%)보다 침윤성 선암(67%)이 많이 발견되었다. 열린 유두를 통해 전형적인 점액 배출은 ERCP의 검사에서 8예(20%)에서 관찰되었다.
총 19명(47.5%)에서 두부 병변으로 췌십이지장절제술을 받았고, 2명(5%)에서 두부와 체부의 병변으로 광범위 췌십이지장절제술을 시행받았다. 또한 병변의 위치가 미부(n = 10) 및 체부과 미부(n = 4)에 있는 환자는 원위부 췌장절제술을 시행받았다. 1명(2.5%)의 환자만이 전체 췌장에 걸쳐 병변이 존재하여 총 췌장전절제술을 시행받았다.
조직병리학 결과를 바탕으로 종양의 특징은 표 2에 요약하였다. 조직병리학 결과에서 종양은 주로 두부(n = 8, 47.5%)에 위치한 것을 알 수 있었다. 침윤성 암을 보이는 15명의 환자 중 9명(60%)이 췌장 두부에 종양이 있었고, 11명(73%)이 주췌관형 IPMN이었다. 25명의 비침윤성(carcinoma in situ, borderline, and adenoma) IPMN 환자 중 13명(32%)의 환자에서 췌장 두부에 병변이 있었고, 9명(36%)이 주췌관형 IPMN이었다. 침윤성 IPMN은 주로 주췌관형(55%, 11/20)이 혼합형 및 분지췌관형(20%, 4/20)보다 더 관찰되었다(p = 0.02).
주췌관형 IPMN에서 종양 범위에 대한 동결절편과 IDUS의 비교
IDUS로 수술 전 평가한 결과와 수술 후 얻은 췌장의 동결절편검사의 병리 절단면을 비교하였다. 수술 중 얻은 동결절편검사는 췌장절제술을 받은 모든 환자에서 시행하였다. IDUS로 수술 전 평가받은 20명의 환자 중 3명(15%)의 환자만이 췌장의 동결절편검사를 토대로 수술 전 계획된 췌장절제술의 범위를 수정하여 수술하였다. IDUS로 수술 전 평가한 환자에서 85% (17/20)에서 동결절편검사에서 음성 결과를 보였다. 반면에 다른 영상검사로 평가한 환자에서는 50% (10/20)에서 음성 결과를 보여, IDUS로 평가한 환자군보다 추가 췌장절제술을 필요로 하였다(p = 0.018; Table 3). 침윤성 IPMN 환자 15명 중 IDUS로 평가한 환자 12.5% (1/8)에서 동결절편검사 결과 양성 결과을 보였다. 반면에 다른 영상학적 검사를 받은 환자 중 57% (4/7)에서 동결절편검사에서 양성 결과를 보여 IDUS로 평가받은 환자에서 낮은 양성 비율을 보였다(p = 0.07). 비침윤성 IPMN의 환자 25명 중 IDUS로 평가한 환자 17% (2/12)는 다른 영상 방법으로 평가한 경우의 39% (5/13)에 비해 동결절편에서 높은 양성의 절제면을 보였다(p = 0.07).
수술 중 평가된 절제된 췌장의 동결절편검사 절단면의 마진은 수술 후에 다시 평가하여 최종 병리보고서를 작성하였다. 비침윤성 IPMN에서 수술 당시 동결절편검사로 음성 결과를 보인 환자 중 1명의 환자에서 재평가된 최종보고서에서 미세침윤을 확인하여 결과를 수정하였다.
ERP와 IDUS 검사 합병증
ERP와 IDUS 검사를 받은 모든 환자에서 췌장염 같은 추후 시술 후 발생할 수 있는 합병증에 대한 평가로 일반혈액검사(complete blood count)와 아밀라아제(amylase)검사를 시행하였다. 췌장염은 Cotton의 진단기준[9]에 따라 진단하였다. 총 2명의 환자(8.7%)에서 췌장염이 발생하였는데, 모두 췌관 확장이 없는 분지 췌관형 IPMN 환자였다. 2명 중 1명은 IDUS로 수술 전 평가한 환자였고, 다른 환자는 IDUS로 평가하지 않은 환자였다. 췌장염의 grade는 1명은 mild, 다른 1명은 moderate를 보였다. 모든 환자는 보존적 치료를 받았다.
재발과 생존율
침윤성 IPMN 환자의 평균 추적 관찰의 데이터는 15명 중 13명에서 얻을 수 있었고, 비침윤성 IPMN 환자에서는 25명 모두에서 가능하였다. 1명의 환자가 연구가 끝나는 시점에서 추적 관찰이 안 되었고, 다른 한 명은 수술 25일 후에 합병증으로 사망하였으나, 재발과 생존율 분석을 위해 intention to treat analysis에 포함시켰다(Table 4). 총 40명의 환자 중 동반 악성 종양질환은 6명(15%)에서 발견되었다. 각각 비침윤성 IPMN의 환자에서는 2명(위암 1명, 대장암 1명)이었고, 침윤성 IPMN의 환자에서는 4명(식도암 1명, 위암 1명, 대장암 1명, 바터팽대부암 1명)이었다. 평균 추적 관찰 기간은 50개월(range, 0.25-136)이었다. 총 3년 생존율은 Kaplan-Meier 방법으로 분석한 결과 79%였다. 전체 누적 3년 무병생존율은 66%를 보였다. 조직병리 형태로 구분하였을 때 누적생존율은 침윤성 암 환자에서 adenoma, borderline 그리고 CIS를 보였던 환자보다 통계적으로 현저히 유의한 수준으로 낮았다(p = 0.023). 15명의 침윤성 IPMN 환자 중 5명(33%)에서 재발하였고, 재발한 환자는 평균 10.4개월(range, 5-18) 추적 관찰 기간을 가졌다. 첫 재발은 평균 6개월에 발견되었다.
재발한 5명의 환자 중 1명은 수술 전에 IDUS로 평가하였고, 동결절편검사에서 음성을 보였던 환자이다. 나머지 4명의 환자는 다른 영상검사를 통해 평가하였고, 그중 3명은 동결절편검사에서도 양성을 보였던 환자였다. 비침윤성 IPMN 환자 25명 중 재발한 환자는 없었다. 하지만 3명의 환자에서 병리 최종보고서에서 절제면 양성 결과를 보였고, 2명의 환자는 각각 대장암과 위암으로 사망하였다.
고 찰
최근 연구에 의하면 췌장 절제면 양성인 IPMN 환자에서 암의 재발이 보고되고 있다[10,11]. 그러므로 완치 목적으로 외과 의사가 췌장절제술을 계획한다면 절제 범위를 결정하는 것이 중요하다. 종양의 관내 침범 여부는 수술 전 시행하는 복부 CT나 MRI같은 영상검사나 수술 중 시행되는 육안적 검사로 예측하는 것은 거의 불가능하다[10]. IPMN의 수술적 절제의 적절한 범위에 대한 이전 연구에 따르면 36-50%에서 조직검사 결과 양성을 보였다[10,12]. 이는 IPMN의 적절한 절제 범위를 정하기 어렵다는 것을 알 수 있는 결과이다. 게다가 IPMN 다발성으로 발생되며, 췌관내 재발은 수술 후 절제면에서 음성을 보였던 환자에게서도 재발이 관찰된다. 복부 CT, EUS, ERCP 및 MRCP를 포함한 영상 검사가 IPMN 병변의 정도를 예측하는데 신뢰할 수 없다는 여러 연구도 있었다[13]. ERCP 검사로 관내 혹은 낭종내 점액 소견, 확장된 유두부를 통한 점액의 배출과 같은 IPMN의 특성을 도출해낼 수 있다. 게다가 주췌관 혹은 분지췌관의 확장 소견도 관찰 가능하다. 하지만, 배출되는 점액의 양이 많으면 조영제가 췌관 내로 진입되기 힘들게 하여 검사를 방해할 수 있어, ERCP는 때때로 전체 관내 구조 및 낭성 병변을 보여주지 못할 수도 있다. 이러한 경우에 ERCP를 이용할 경우 벽내 결절이나 종양의 범위 정도에 대해 정확한 검사가 불가능하다.
췌장 MRI와 MRCP 검사는 유용하지만, 수술 전 작은 벽내 결절이나 침윤 정도 및 췌관내 병변의 확장 정도를 정확히 평가하기 어렵다[14].
EUS는 종양을 가시화하는데 유용한 검사로 알려져 있다. 그러나 EUS는 정교한 기술이 필요하며, 진단의 신뢰도는 검사자의 숙련도에 많이 의존하는 검사이다[15]. 또한, Cellier 등의 연구[3]에 의하면 EUS에서 30% 이상 종양의 범위 정도를 정확히 검사하는데 실패하였다고 한다. 하지만 IDUS는 EUS보다 고주파를 이용하기 때문에 높은 해상도를 제공 가능하다. 그래서 더 좋은 이미지를 제공하여 더 정확한 조직병리학적 결과를 제공한다. 또한 EUS와 달리 검사자의 기술 수준에 많은 영향을 받지 않고, 특히 췌장의 작은 병변을 관찰하는데 유리하다. IDUS는 췌관의 산토리니관의 미세 확장 정도 및 분리 췌장(pancreas divisum)(Fig. 2A and 2B) 뿐만 아니라, 복부 CT, MRI와 MRCP, ERP에서 검사하기 힘든 췌장내 벽 결절이나 낭성 병변을 관찰 가능하다. 하지만 IDUS는 췌장의 두부의 주췌관에서 3 mm 벽 결절까지 관찰 가능하였고(Fig. 2C), 췌장절제술 이후에 최종 병리검사 결과 침윤성 암으로 보고되었다(Fig. 2D).
췌장의 절제 부위를 결정하는데 있어서, IDUS는 췌관 표면의 미세한 변화를 가시화할 수 있었다. 본 연구를 통해 수술 전 IDUS의 높은 정확도가 췌관내 종양의 범위를 정의하는데 유용하여, 췌장절제술의 범위를 결정하는데 도움을 줄 수 있다는 것을 알 수 있었다. 계획된 췌장절제술에서 IDUS 외에 다른 영상 방법으로 접근한 환자의 경우 동결절편 절제면의 검사 후 수정된 환자는 50% (10/20)였고, IDUS로 평가한 환자에서는 15%(3/20)였다. 이는 췌관내 병변의 범위를 평가 및 췌장절제술의 범위를 정하는데 있어 IDUS가 복부 CT/MRI 또는 ERP보다 우수하다는 것을 알려주는 결과이다.
절제된 췌장 단면에서 양성 경계면을 보이는 비침윤성 IPMN 환자에의 추후 관리는 아직 자연사가 밝혀지지 않았기 때문에 논란의 여지가 있다. 그러나 침윤성 IPMN의 경우 경계면에서 음성이 보이더라도, 추가 절제술을 시행하는 것은 필수적이다. 본 연구에서 췌장절제술 후 재발한 절제면 병리검사 결과 이형성을 보였던 침윤성 IPMN의 환자 4명 중 1명은 추가 절제술을 받지 않았던 환자의 췌장 절제면에서 재발은 추적 관찰 6개월 때 관찰되었다. 이전의 연구에 따르면 이형성 또는 암의 존재가 재발의 예측인자이다. 재발성 침윤성 IPMN은 불량한 생존율의 예측인자이다[10]. 따라서, 본 연구에서 침윤성 IPMN 환자에서 수술 전 병변의 범위를 평가하는 것은 중요하다고 판단했다. 침윤성 IPMN 환자의 73%는 주췌관의 확장과 연관이 있었다. IDUS는 수행하기 편하고, 주췌관형 IPMN에서 합병증 없이 시술 가능하다는 장점이 있다. 본 연구에서 침윤성 IPMN 환자 15명에서 IDUS로 수술 전 검사한 환자군 12.5% (1/8)에서 동결절편검사 절제면 검사에서 양성 소견을 보였고, 다른 영상 방법으로 평가한 경우는 57% (4/7)였다(p = 0.07).
IPMN은 종종 다른 원발 신생물과 관련이 있다. IPMN 환자에서 췌장 외 다른 악성 종양의 유병률은 17-39%를 보였다[16-18]. 대장암과 위암은 이전 연구에서도 가장 IPMN과 관련이 있는 악성 종양으로 발표된 적이 있다[16,17]. 본 연구에서 IPMN과 연관된 췌장 외 암의 발생률은 15% (6/6)였다. 위암(33%, 2/6)과 대장암(33%, 2/6)이 가장 흔하게 발생하였다. 이 결과는 위암이 한국에서 가장 흔하게 발생하고, 동시에 다발성 원발성 암중에 가장 연관된 종양이기 때문일 것이다.
IPMN에서 수술 전 IDUS로 수술의 종류 및 절제 범위를 정하는 것이 필요하며, 특히 주췌관형 IPMN에서 유용하다고 결론내릴 수 있겠다.
본 연구는 몇 가지 한계가 존재한다. 첫 번째는 소수의 환자만이 본 연구에 참여하였고, 단일 센터에서 진행된 것이다. 둘째는 췌장경 검사를 시행하지 않았다. 마지막으로 본 연구에서는 복부 CT/MRI, ERP와 IDUS로 진단된 IPMN의 병변의 범위를 서로 비교하지 않았다는 것이다. 따라서 위의 도출된 결과를 증명하기 위해 다수의 센터가 참여한 비교 연구가 필요할 것으로 생각된다.