서 론
초음파 영상은 비용 편익을 고려할 때 간질환의 일차적인 진단 도구로 현재 널리 사용되고 있다. 기존의 도플러 초음파 검사와 파워 도플러 초음파 검사가 간 내 병변의 혈류 평가를 통한 병변의 진단에 도움을 주고 있지만, 해당 검사들은 저주파수 영역의 신호 평가나 환자의 움직임 등에 취약한 단점이 있고, 조영제를 사용한 초음파 검사의 경우에도 조영제를 사용해야만 한다는 근원적인 제한점이 있어, 이러한 점을 극복하기 위해서 최근 미세혈관 초음파 영상 기술을 이용한 초음파 검사법이 새로이 도입이 되었다. 본 종설에서는 기존 초음파 기술들의 단점과 이를 일부 대체할 수 있는 미세혈관 초음파 기술의 장점 그리고 해당 기술의 제한점 및 현재까지 알려진 간 병변 평가의 임상적인 활용에 대해 알아본다.
본 론
기존 초음파 검사의 단점
간 병변의 평가를 위해 사용하는 초음파 기술 중 보편적으로 사용하는 기존의 도플러 초음파(Doppler ultrasound imaging) 검사는 혈류의 움직임이 아닌 환자의 움직임과 호흡에 따른 인공물(artifact)을 제거하기 위해서 반향 인공물(clutter artifact)에 따른 저주파수 영역의 신호(low-frequency signal)를 억제하기 위한 벽필터(wall filter)를 사용하게 되는데 이럴 경우 실제 간 내 병변 자체의 미세혈관(microvessel)에서 발생되는 신호까지 동시에 제거하거나 억제하게 되어, 해당에 대한 평가를 도플러 초음파로 하기에는 한계가 있다[1].
파워 도플러 기술(power Doppler imaging)의 경우는 적혈구의 움직임에서 증폭된 신호를 바탕으로 작은 혈관의 분포를 보여주는 기술로 도플러 초음파 기술보다 좀 더 작은 혈관을 나타내는 데 민감한 성능을 보이고 초음파의 각도(angle)에 영향을 받지 않는 장점이 있지만[2], 단점으로는 해당 기술 자체가 움직임에 대단히 민감하여, 검사 도중 환자의 작은 움직임에 의해서도 심한 영상의 저하를 가져오게 된다.
혈관 자체를 채워서 평가하는 기술로는 조영증강 초음파 검사(contrast-enhanced ultrasound)가 있는데, 해당 기술은 실시간으로 간의 미세혈관 관류를 평가할 수 있는 장점이 있으며, 간 내 병변 평가에 있어, 좋은 해상도와 정확도를 제공해준다. 하지만 조영제를 부가적으로 사용해야 하는 단점이 있으며, 조영제 부작용이 있는 환자이거나 검사 방법에 익숙하지 않은 의사의 경우 매우 짧은 시간만에 동맥기가 지나가서 정확한 병변의 혈류 역동학적인 점을 평가하기 위한 시간적인 해상도(temporal resolution)의 제한이 있어, 실제 임상에서 활용이 쉽지가 않다.
미세혈관 영상의 특징
고해상도 초음파를 이용한 미세혈관 영상은 저주파수 영역의 인공물만을 제거하는 특화된 필터링 기술을 사용하여 미세혈관 내 흐르는 느린 혈류의 신호는 남겨서 평가할 수 있는 새로운 도플러 초음파 기술이다[3]. 이에 매우 느린 혈류를 가지는 미세혈관을 초음파 조영제 없이 평가가 가능하다. 또한, 해당 기술을 이용한 정량적인 parameter 분석을 통하여, 조직의 혈류량을 vascular index로 나타낼 수가 있다. 각각의 초음파 회사에서는 해당 원리의 초음파 기술을 아래와 같이 제품명으로 기술을하고 있다. 삼성메디슨의 경우 MV flowTM, Cannon사의 경우 Superb Microvascular ImagingTM (SMI), GE의 경우 B-flowTM 등의 상용화된 상품명을 사용하지만, 모두 비슷한 기술을 기반으로 한 미세혈관을 자세히 평가하기 위한 초음파 영상 기술이며, 본문에서는 Cannon사의 SMI를 기준으로 기술을 한다. SMI는 두 가지의 디스플레이 형태가 있는데, 하나는 B-mode gray scale 초음파 검사에서 해당의 혈류 정보에 대해 색깔을 입혀 보여주는 color SMI 기능이며, 또 다른 하나는 비록 단색으로 보여주지만 조금 더 민감도가 높은 monochrome SMI 기능이다[4].
미세혈관 영상의 원리
도플러 효과(Doppler effect)란 측정하고자 하는 물체에서 나온 파동의 진동수가 실제 진동수와 다르게 관측되는 현상으로 1842년 크리스티안 도플러(Christian Doppler)가 제안한 물리 현상이다. 컬러 도플러 기술은 반향 인공물에 의한 신호를 제거하기 위해서 일차원(one dimensional)의 벽필터를 사용하게 되는데 이러한 과정은 필수 불가결하게 낮은 속도의 혈류에서 나오는 신호를 무시하게 된다[5]. 하지만 SMI의 경우는 3차원의 필터 기술을 이용하여 인공물에 의한 noise는 제거하는 대신에 느린 혈류 속도에서 나오는 신호를 획득할 수 있는 최신의 기술이다(Fig. 1).
간의 미세혈관 영상 검사 시 주의할 점
미세혈관 영상은 기본적으로 초음파 기술을 바탕으로 하므로, B-mode 초음파의 화질 저하를 일으킬 수 있는 모든 상황에서 SMI 영상 또한 화질 저하가 일어나기 쉽다. 간의 표면에 가까운 병변의 경우는 SMI 영상을 통한 병변의 신호 획득이 쉬워 화질이 상대적으로 좋지만, 간 표면으로부터 10 cm 이상으로 떨어져 있는 깊은 곳에 위치한 간 병변 내부의 혈관 패턴 평가는 제한적일 수가 있다. 또한, 비만한 환자나 지방간이 심한 환자에서는 지방간에 의한 초음파 감쇄(attenuation)가 심하여, 비록 간 표면 근처에 있는 병변이라고 하더라도 신호 획득에 제한이 있을 수가 있다. 마지막으로는 1 cm 미만의 매우 작은 간 병변의 경우 해상도의 한계로 내부의 작은 혈관 평가에 제한이 있어, 작은 국소 결절성 과증식증(focal nodular hyperplasia)을 포함한 크기가 작은 병변들은 SMI 영상으로도 정확한 병변 내부의 혈류 특성 파악이 어렵다[6].
간 미세혈관 영상의 임상적인 적용
간에 대한 SMI의 임상적인 활용으로 크게 간섬유화 평가 및 간 내 국소 병변 평가로 나눌 수가 있다. 국소 병변에 대한 SMI의 역할은 양성 병변에 대한 검사와 악성 병변에 대한 검사로 나눌 수가 있다. 간섬유화 평가로는 SMI는 기존의 도플러 초음파 기술보다 미세혈관 평가에 민감하므로, 간경화의 진행에 따른 혈관의 무뎌짐(blunting)과 사행(tortuosity)의 확인에 더 유용할 수가 있고, 향후 간섬유화 평가에 SMI를 통한 연구 자료가 많이 쌓일 경우에는 조직 검사를 대체할 수 있는 간편한 섬유화 평가 기술 중의 하나가 될 수 있을 것으로 보인다[7].
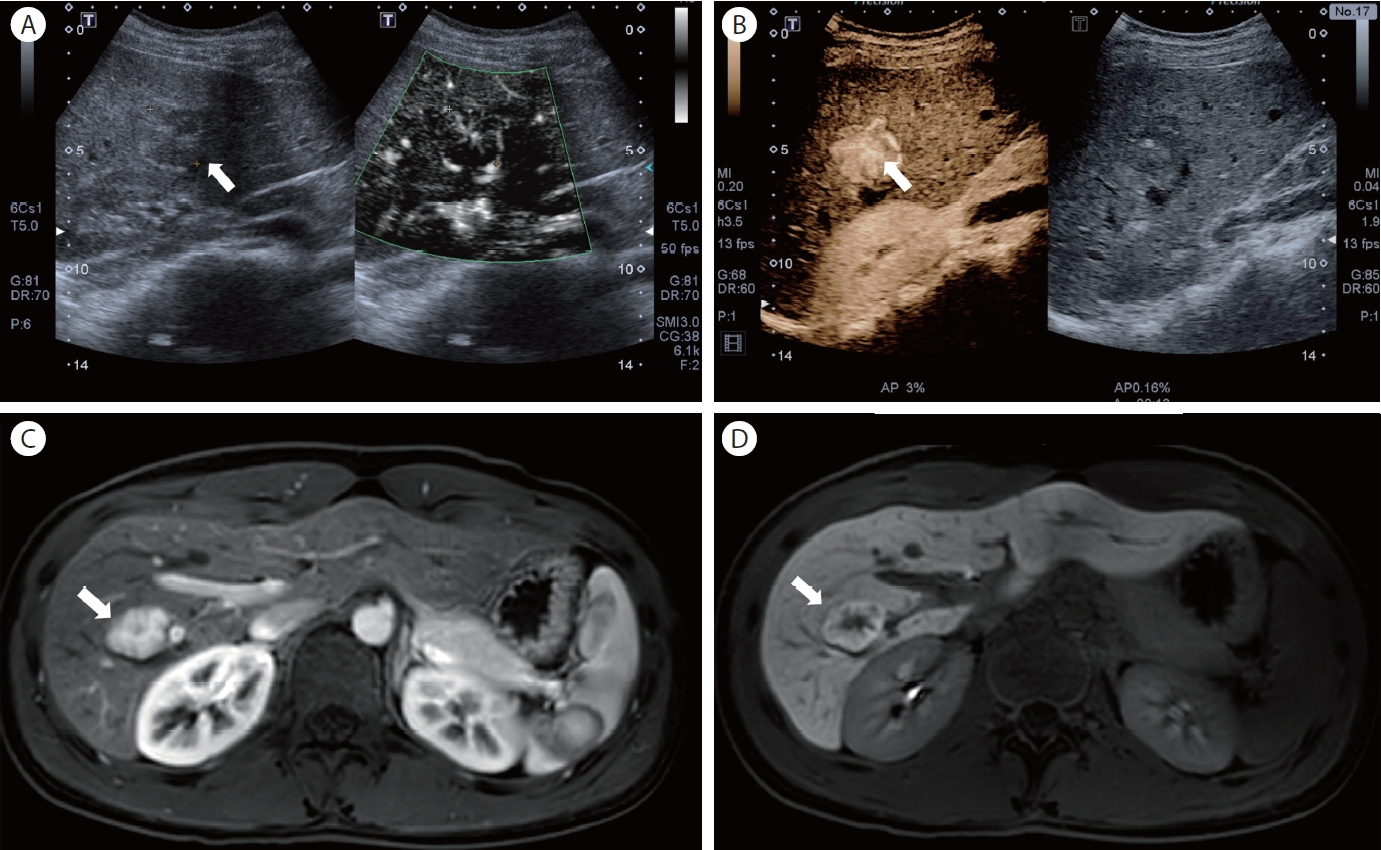
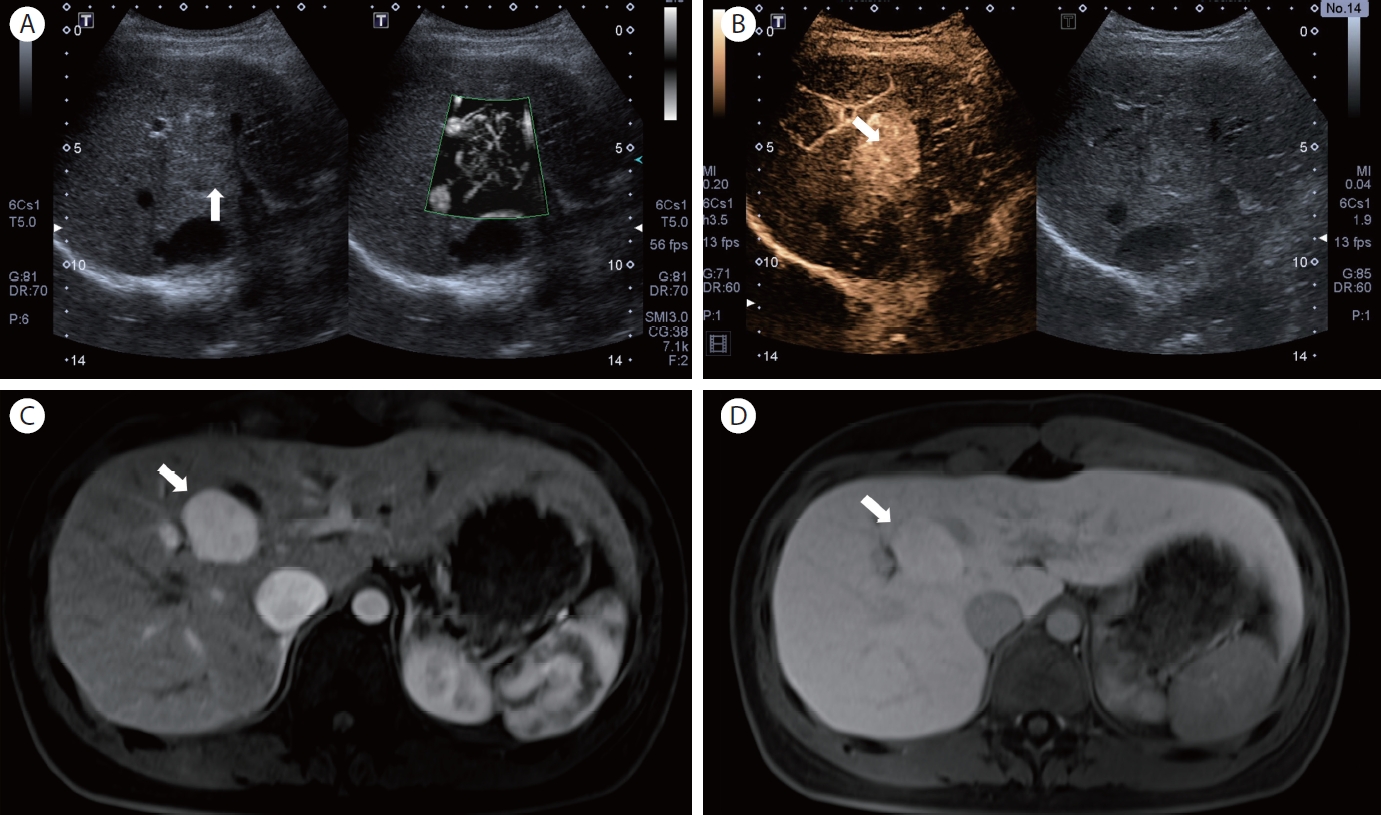
양성 병변으로는 제일 흔한 혈관종(hemangioma)에 대해서 29개의 혈관종에 대한 최근 연구에서는 SMI를 사용하였을 때 가장 흔하게 관찰되는 미세혈관 패턴은 nodular rim 패턴이 33%였고, 그 다음으로는 spotty-dot 패턴이 20%를 보였다[8]. 이러한 소견들은 실제 초음파 조영제를 사용한 조영증강 영상에서 볼 수 있는 초음파 소견으로 조영제 없이 이러한 특징적인 소견을 관찰할 수가 있을 때는 혈관종과 다른 간 내 종양을 1차적으로 감별하는 데 도움을 줄 수가 있다. 국소 결절성 과증식증의 경우 SMI가 감별 진단에 도움이 되는 매우 유용한 질환이다. 이유는 해당 병변은 중심부 반흔과 동반된 가는 동맥들이 중심부에서 종괴의 변연부로 퍼져나가는 병리적인 특징을 보이며, 이런 병리 소견은 초음파 조영제를 사용한 검사에서 특징적인 마차 바퀴 모양(spoke-wheel sign)의 조영증강 특징을 보인다[9]. 최근 시행한 초음파 조영제를 사용한 조영증강 영상 검사와 SMI를 사용한 영상 검사의 국소 결절성 과증식증의 진단능을 비교한 전향적 연구에서는 62개의 병변 중 해당 마차 바퀴 모양이 초음파 조영제 사용군에서는 71% (44/62), SMI군에서는 63% (39/62)가 확인되었고, 이는 통계적으로 양 군 간에 유의미한 차이가 없었으며, 이러한 결과는 결국 초음파 조영제를 사용하지 않아도, SMI만으로도 국소 결절성 과증식증을 초음파 조영제를 사용한 환자와 마찬가지로 유사하게 진단할 수 있다는 임상적인 의미를 보여준다[6] (Fig. 2 and 3). 하지만 혈관종과 국소 결절성 과증식증 모두 병변이 너무 작을 경우는 내부 혈관 평가가 제한적이어서 그 외 추가적인 CT 또는 MRI 등의 검사가 필요할 수 있다[10].
간의 악성 종양에 대해서는 최근 연구에서 SMI의 사용이 간세포암종(hepatocellular carcinoma) 내부의 혈관 분포 평가에는 도움을 얻을 수 있으나, 다른 악성 종양과의 감별 진단을 할 수 있을 만한 특이적인 소견은 확인할 수가 없었다[8]. 또 다른 연구에서는 간세포암종은 diffuse honeycomb 형태(40%) 또는 비특이적인 혈관 패턴(60%)을 흔하게 보였고, 간 내 전이암의 경우에는 strip rim 형태의 혈관 패턴(80%)을 가장 흔하게 보여, 이는 종양의 변연부에 주로 위치한 섬유화되지 않은 종양 세포의 혈류량 증가에 따른 것으로 추정이 된다[10]. 하지만 이를 이용한 임상적인 활용의 제한점은 최근 간 내 악성 종양의 SMI 연구에서도 밝혀진 바와 같이 악성 종양의 경우 변연부의 혈관 분포 증가가 양성 병변에 대해서 상대적으로 흔하나 해당에 기초한 진단적인 정확성은 상대적으로 낮으며, 진단적 정확성 지표(area under the curve)는 0.64 정도밖에 되지 않았다[11]. 이유는 단순히 간 내 병변 자체의 내부 혈관 증가가 악성 병변과 직접적인 연관성이 있지 않기 때문이다. 이를 고려할 때 SMI를 통한 간 내 악성 및 양성 병변의 감별 진단은 아직은 더 많은 연구가 필요할 것으로 보이며, 현재까지로는 간 내 종양의 혈관 분포를 이용하여, 국소 병변의 정확한 감별 진단이 아닌 특징 파악에는 도움이 될 것으로 생각이 된다.
미세혈관 영상의 제한점
미세혈관 영상 또한 초음파란 기술을 바탕으로 하므로 초음파 기술 자체가 영향을 받는 모든 인공물이 만들어지는 상황에 취약할 수밖에 없다. 예를 들어, 초음파 검사 도중 발생하는 환자의 호흡 운동이나 심박동에 따른 인공물이나 화질 저하는 피할 수가 없다. 다음으로는 파워 도플러 검사와 유사하게 동맥과 정맥 자체를 구별해서 나타낼 수가 없으며 기존의 컬러 도플러 검사와 달리 방향성의 정보를 가지고 있지 않다. 마지막으로는 SMI 자체가 비교적 최근에 나온 기술로써 아직 많은 임상적인 논문들로 다양한 질병 및 임상 상황들에 대한 과학적인 검증이 아직은 부족한 상황이며, 여러 전향적인 연구들이 향후 이러한 부족한 점을 해결해 줄 것으로 생각된다.