서 론
초음파 검사는 방사선 노출이 없고, 안정성이 높으며, 검사가 간편하고, 장비가 많이 보급되어 있어 다양한 분야에서 진단 목적으로 가장 널리 이용되는 영상검사법이다. 미세기포 초음파 조영제(microbubble ultrasonography contrast)를 이용한 조영증강 초음파(contrast enhanced ultrasonography)는 실시간으로 초음파를 시행하면서 정맥을 통해서 투여된 조영제가 혈관 및 장기 조직에 확산되면서 나타나는 여러 가지 조영 양상을 통해서 진단함으로써 좀 더 높은 진단력을 보여 준다. 특히 2000년대 중반부터 도입된 2세대 초음파의 등장은 간세포암의 진단에 있어서 진단 정확성을 높일 뿐만 아니라, 초음파 유도하 시술이 필요한 경우에 큰 도움이 되고 있으며, 현재 대한간암학회-국립암센터의 간세포암종 진료 가이드라인에서도 간세포암종 진단의 보조 검사법으로 인정되고 있다. 더욱이 최근에는 조영제 초음파를 이용하여 간섬유화 및 간경변증의 정도를 평가하고 나아가 이에 따른 문맥압항진증의 중증도를 평가하고자 하는 시도가 이어지고 있다. 본문에서는 2세대 초음파 조영제의 특성을 소개하고 이를 활용하여 간섬유화와 문맥압항진증을 평가하고자 하는 연구들을 살펴보고자 한다.
본 론
초음파 조영제의 종류와 특성
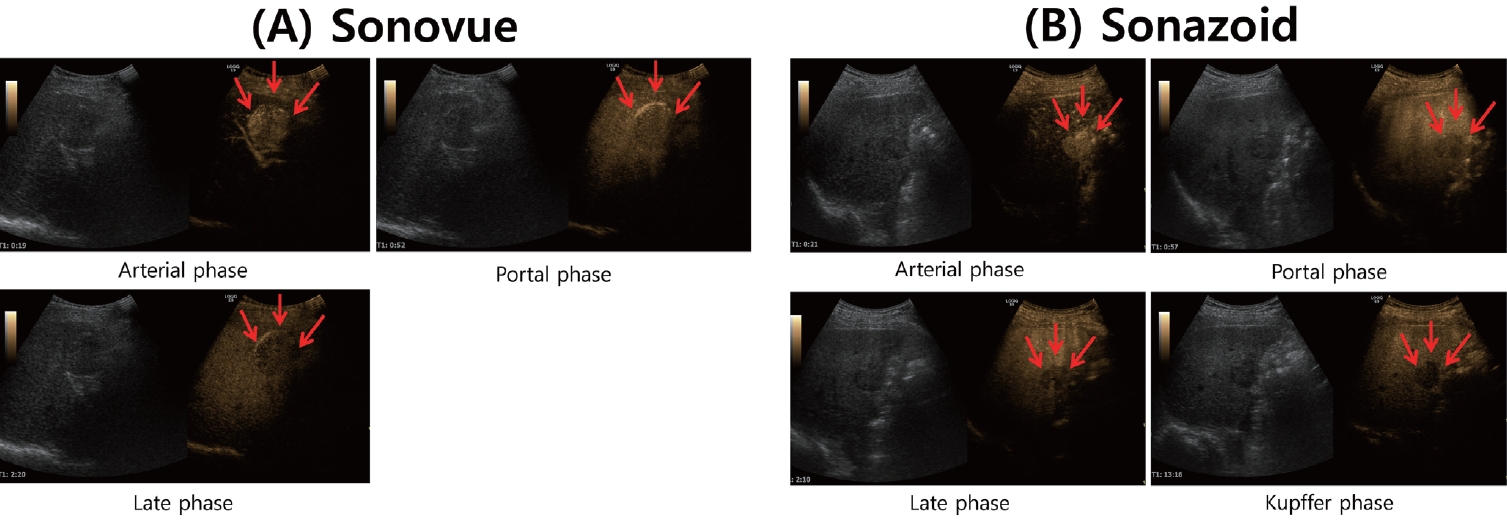
우리나라는 간질환에 이용 가능한 대표적인 2세대 초음파 조영제인 SonoVue® (Bracco, Milano, Italy)와 Sonazoid® (Daiichi Sankyo, Tokyo, Japan)가 모두 이용 가능한 몇 안되는 국가 중 하나이다. 이들은 모두 기체와 이를 담고 있는 지방질의 미세기포(microbubble)로 구성되며, 초음파 파동에 대해 미세기포가 공진 또는 붕괴하면서 강한 반사를 일으키는 현상을 이용하고 있다[1]. 이들 기체를 싸고 있는 지질막은 조영제에 따라 다소 차이가 있으며, 미세기포는 대부분이 2–10 μm 전후의 크기로 적혈구와 비슷하며, 모세혈관을 잘 통과하기 때문에 말초 정맥으로 주사하더라도 우심계와 폐를 통과해서 좌심계를 통해서 전신 순환이 가능하게 되어 목표 장기에까지 도달하게 된다[2].
간 내에서 초음파 조영 양상은 간동맥과 간문맥의 이중 혈류 구조와 투여된 후 혈류 도달 속도의 차이에 의해 혈관기를 동맥기(10–20 sec), 문맥기(30–45 sec) 및 지연기(>120 sec)의 3개의 단계로 나누게 된다[3,4]. 이들 각 단계에 나타나는 특징적 초음파 조영상을 토대로 병변을 감별하게 되는데, 동맥기의 조영증강은 국소적인 간병변(focal liver lesion)을 찾는데 유용하며, 지연기는 간세포암종 등의 경우에는 간 동양혈관(sinusoid)에 혈액이 충분히 채워지지 않고 단락(shunt) 등에 의해 바로 제거되기 때문에 마치 역동적 간 컴퓨터단층촬영상의 씻김 현상(washout) 과 유사한 양상을 보여 악성종양을 감별하는데 유용하다. 또한, 이러한 특징은 조영되는 간 실질의 조영 강도 및 혈관 조영의 강도 및 시간대의 차이를 만들어, 간 실질의 병적 상태 및 혈역학적 변화를 비침습적으로 확인함에 있어서 도움이 될 것으로 생각된다. 대표적인 조영제인 SonoVue®와 Sonazoid®의 특성을 간략히 기술하면 아래와 같다(Table 1).
SonoVue®
2001년 이탈리아의 Bracco사에 의해 처음 개발 및 시판되기 시작하였으며, 특징적으로 물 및 혈액에 잘 녹지 않고 매우 안정적인 sulfur hexafluoride gas를 2–10 μm의 phopholipidic monolayer shell 안에 담고 있는 미세기포이며, 다른 조영제와 달리 주변 세포에 의한 탐식이 적고 주로 크고 작은 혈관 내에 머물러 있어, 혈관상의 특성을 평가하는데 도움이 된다. 또한 혈관의 특정 시간대의 조영 강도 등을 평가함에 있어서는 유용하여, 간섬유화와 이에 따른 간 내부 및 외부의 혈관 분포의 변화와 혈역학의 변화를 평가함에 이용이 될 수 있다. 특히, SonoVue®는 초음파 파동 등에 대한 미세기포 껍질의 탄성도와 안정성이 좋아서 다양한 주파수의 초음파에서 안정적으로 사용이 가능하고, 기계적 지수(mechanical index, MI)값에 따라 미세기포의 진동, 파괴 두 가지 용법 사용이 모두 가능하다[5].
Sonazoid®
Sonazoid®는 2011년까지는 일본에서만 사용이 가능하였던 조영제로, 2012년부터 국내에서도 출시가 되어 현재는 간세포암종의 진단을 중심으로 그 이용도가 증가되고 있다[5]. Sonazoid®는 지질로 구성된 껍질내에 perflubutane gas를 담고 있으며, 크기는 SonoVue®와 유사하다. Sonazoid® 역시 SonoVue®와 마찬가지로 낮은 기계적 지수값(0.1–0.2)에서 관찰이 가능하다. 그러나 Sonazoid®는 정맥 투여 후 조영증강이 특징적으로 크게 두 개의 단계 즉, 처음 약 1–2분간의 혈관 조영기(동맥기; ~30 sec, 문맥기; ~120 sec 및 지연기)와 약 10–15분 후의 혈관 후 단계(post-vascular phase, Kupffer phase)로 나눌 수 있다. 이는 SonoVue®와 다르게 Sonazoid®는 투여 약 10분 이후에 간 실질 내의 쿠퍼(Kupffer)세포에 의해 탐식되기 때문에 나타나는 것으로, 간세포암과 같이 정상적인 쿠퍼세포가 존재하지 않는 경우에는 이러한 탐식 효과가 없어서 쿠퍼기에 병변이 조영증강 없이 검게 결손으로 나타나기 때문에, gadolinium 조영증강 자기공명영상에서의 것과 유사한 혈관 후 단계를 만들어 내며, 이는 조영증강 초음파의 유용한 장점의 하나가 된다(Fig. 1) [6]. 특히, 이러한 특성은 간섬유화의 진행에 따라 간 실질이 감소하고 쿠퍼세포가 감소하게 되면 간실질의 초음파 조영도 약해질 수 있어 이러한 특성을 이용하여 간 내부의 조직학적 변화나 간 실질의 양도 비침습적으로 평가해 볼 수 있지 않을까 하는 관심들이 높다.
Safety
초음파 조영제는 신독성이 없다는 큰 장점을 가지고 있어, 컴퓨터단층촬영 등을 시행하기 어려운 경우에도 안전하게 시행할 수 있고[7], 기타 부작용도 거의 없는 것으로 보고되고 있다. 조영제에 대한 알레르기 또는 과민성은 매우 낮으며, 생명을 위협할 만한 아나필락시스 반응이 0.001%에서 발생하는 것으로 알려져 있다[8]. 또한, 컴퓨터단층촬영과 달리 반복적인 검사에도 방사선 노출의 위험이 없다는 것이 큰 장점이 될 것이다[9–11]. 다만, 관상동맥 질환을 가지고 있는 경우에는 주의가 필요하며, 신결석에 대한 체외충격파쇄석술을 시행하는 경우에는 최소한 24시간의 간격을 둘 것을 권하고 있다. 또한, 임산부나 수유를 하는 경우에는 가능한 한 사용하지 않도록 한다[12].
간경변증 및 문맥압항진증에서의 조영증강 초음파의 임상적 활용
조영증강 초음파의 활용은 간 내 국소 병변의 감별에 가장 흔하게 이용되고 있으며, 그 외에 국소 병변의 조직검사 또는 치료에 있어서 정확성과 성공률을 올리기 위한 가이드 역할을 하고 있고, 치료 후의 치료 반응 평가에서도 유용한 것으로 알려져 있다. 그러나 최근에는 2세대 초음파 조영제의 특성에 기반하여 간섬유화와 간경변증 및 이에 수반되는 문맥압항진증에 대해서 조영증강 초음파를 이용한 간섬유화의 진행에 따른 간내외의 혈관 및 혈역학의 변화, 간 내 조직 소견의 변화를 평가하고자 하는 시도들이 이루어지고 있다.
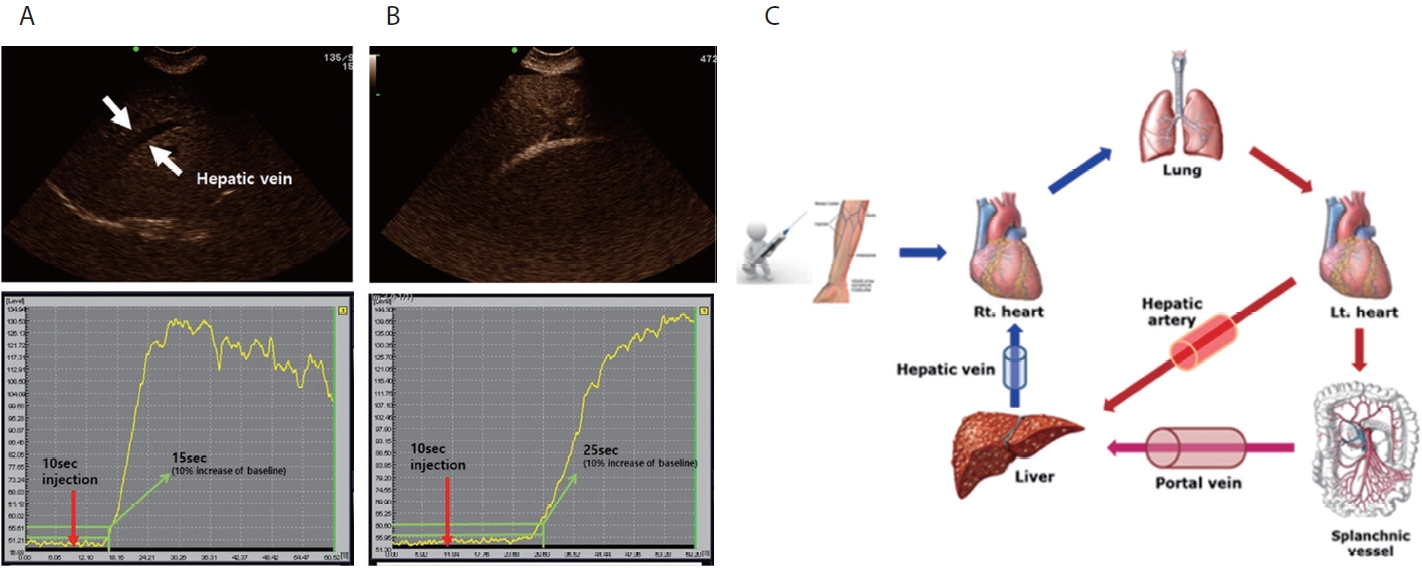
미세기포 제재의 정맥 주입 후 간 실질이나 간 내 혈관으로의 미세기포의 이동 시간과 조영 강도의 평가가 질환의 평가에 도움이 될 수 있다. 일정 조영 강도에 이르는 시간의 평가 또는 일정 시간에 조영되는 강도의 평가가 가장 기본적인 표지자가 될 수 있다. 간 질환이 악화되면 간 내외 혈관 단락의 형성으로 인해서 미세기포 조영제의 간정맥 도착 시간(hepatic vein arrival time, HVAT) 또는 간내 통과 시간(hepatic transit time, HVTT)이 감소하게 된다. 이들은 간 내 또는 간 외 혈역학적 변화를 반영하고 질환의 중증도와 상관관계가 높은 것으로 알려져 있다(Fig. 1) [13–17].
이론적으로 만성 간 질환 환자의 짧은 HVAT는 주로 동정맥 단락(arteriovenous shunting), 동양혈관의 변화(sinusoid remodeling), 간의 모세혈관층 동맥화(capillarization)에 의해 이차적으로 나타나며, 정도는 덜하지만 폐 및 위장 모세혈관의 단락도 영향을 미친다. 대상성 간경변증 환자에 대한 연구에서 HVAT는 문맥압항진증과 매우 강한 상관관계를 보여주었다. 임상적으로 유의한 문맥압항진증(clinically significant portal hypertension, CSPH) 진단을 위한 HVAT의 Area Under the Receiver Operating Characteristics (AUROC)는 0.973이었다. 또한, 더 짧은 HVAT는 더 나쁜 간기능(높은 Child-Pugh 점수) (p < 0.001) 및 식도 정맥류(p = 0.018)와 관련이 있었다(Fig. 2) [15]. 정상 간 실질과 간경변증 간의 시간 강도 곡선(time intensity curve) 또한 유의미한 차이를 보이며, 감소 정도는 현재 간 손상 정도 또는 문맥압항진증과 관련이 있었다[15,18]. 이 연구들은 초음파 검사 조건이 양호한 환자들을 대상으로 하여 높은 AUROC를 보였으며, 실재 임상에서는 초음파 검사 자체가 갖는 한계로 그 유용성에 다소 차이가 있을 수 있겠으나, 간경변증 및 문맥압항진증의 병태 생리에 근거한 혈역학적 변화를 비침습적으로 평가하였다는 의의가 있다.
조영증강 초음파에 의한 조영제의 신호 강도 또한 유용한 지표가 될 수 있다. Berzigotti 등[19]은 국소 간 관류(regional hepatic perfusion, 미세 기포 속도 × 미세 기포의 농도로 계산)는 간경변 증 환자에서 증가하며 이는 간부전 정도와 상관관계가 있음을 보고한 바 있다. 국소 간 관류는 인도시아닌 그린 청소율(indocyanine green clearance)로 측정한 간기능의 감소와 함께 증가했는데, 이는 조영증강 초음파가 국소 간 관류 추정을 위한 새롭고 실현 가능하며 정량적인 비침습적인 도구임을 제시한다. 본 연구에서 국소 간 관류는 간정맥압력차(R = 0.279, p = 0.041)와 양의 상관관계를 보였으며, 프로프라놀롤 정맥 투여 후 감소하는 경향을 보였다(p = 0.08). 또 다른 연구[20]에서는 신호강도를 통해 비알코올성 지방간염에서는 간 실질 내 미세기포 축적이 감소하는 것으로 나타났으나, 비알코올성 지방간질환이나 만성 바이러스성 간염에서는 감소하지 않는 것으로 나타났다. 이는 조영증강 초음파를 이용한 간실질의 신호강도 측정이 간내 조직학적 변화를 비침습적으로 예측할 수 있는 또 다른 방법이 될 수 있음을 시사한다.
앞서 언급한 바와 같이 Sonazoid는 세망내피계(reticuloendothelial system)에 축적되는 특성을 갖으며, 또한 간의 혈관 후 단계에서도 쿠퍼세포에 흡수되어 조영 현상을 나타내게 되는데, 이러한 현상 또한 간실질의 변화를 비침습적으로 평가함에 도움이 될 수 있다. 203명의 피험자를 대상으로 한 연구에서 혈관 후 단계의 신호 강도는 간섬유화 단계에 따라 ≥F2의 경우 0.88, ≥F3의 경우 0.95, 간경변(F4)의 경우 0.97의 AUROC를 나타내었으며 [21], 이는 Fibrosis-4 index (FIB-4)에서 얻은 결과보다 우수하였다(≥F2 0.85, p = 0.15; ≥F3 0.89, p = 0.057; F4 0.90, p = 0.017). 같은 2세대 초음파 조영제로서 SonoVue는 쿠퍼세포에 의한 탐식이 되지 않는 대신 혈관에 더 특이적으로 분포함으로서 혈관 조영 상태 및 동적 변화를 보는데 더 유용할 수 있다. 이에 반해 Sonazoid는 탐식된 미세 기포와 신호 강도의 정적 이미지를 비교함으로서 표적 안정성이 높고, 간실질의 변화를 평가함에 더 유용할 수 있다. 즉, 두 대표적인 초음파 조영제는 각각의 장단점이 있고 이용할 수 있는 분야 또한 서로 차이가 있으며, 이를 활용하여 다양한 조영증강 초음파 기반의 표지자들을 발굴해 낼 수 있을 것으로 기대된다. 또한, 결과를 해석함에 있어서 SonoVue와 Sonazoid 사이에 차이가 있을 수 있다는 점도 유의해야 한다[22].
결 론
간섬유화 및 문맥압항진증에 대한 조영증강 초음파 기반 검사는 비침습적으로 조영제 통과 또는 간 실질의 조영제 증강 강도 패턴을 기반으로 간단하고 비침습적으로 평가할 수 있을 것으로 기대된다. 조영증강 초음파 기반 검사는 진행성 만성 간질환에 필수적인 간내 또는 전신 혈류역학적 변화를 평가하는 데 유용할 수 있으며, 간 실질의 섬유화 정도 및 간기능의 평가에도 도움이 될 것으로 기대된다. 그러나 조용증강 초음파를 이용한 이러한 검사는 일반 초음파가 가지고 있는 태생적 한계를 공유한다. 즉, 음향창이 좋지 않은 환자나 비만한 경우, 호흡 등 움직임에 의한 허상, 혹은 환자가 협조가 잘 되지 않는 경우가 검사가 제한적일 수 있다. 또한 조영제 주입이 필요하고 측정 및 해석에 있어서 숙련도가 요구된다. 조영증강 초음파를 기반으로 하는 비침습적 간섬유화 및 문맥압항진증 평가 지표 개발을 위 해서는더 많은 연구를 자료 확보와 검증이 필요하다.